Sagsbehandlingstider for udstedelse af markedsføringstilladelser til modtagerlandssager 2015
I den gensidige anerkendelsesprocedure samt i den decentrale procedure har vi 30 dage til udstedelse af markedsføringstilladelse efter modtagelsen af en acceptabel dansk udgave af produktinformationen.
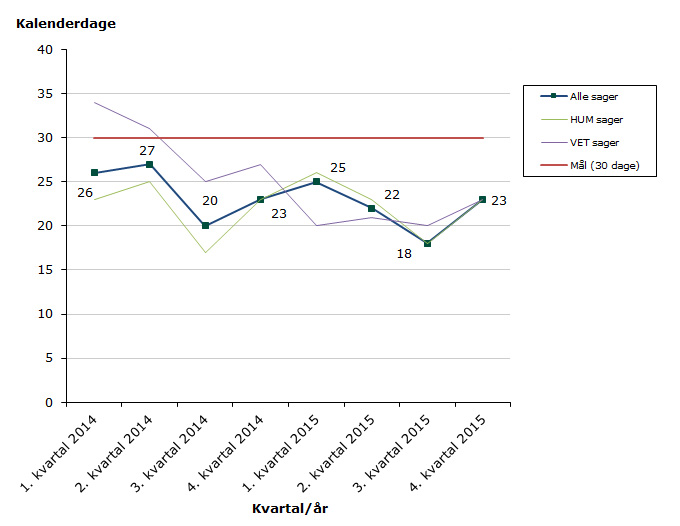
Status for 2015 tom. fjerde kvartal: 96 % af sagerne overholder resultatkravet på sagsbehandlingstid på 30 dage (gennemsnitligt 22 dage):
- Humane lægemidler: 96 % af sagerne overholder resultatkravet og den gennemsnitlige sagsbehandlingstid er 22 dage
- Veterinære lægemidler: 98 % af sagerne overholder resultatkravet og den gennemsnitlig sagsbehandlingstid er 21 dage
Figur 1: Gennemsnitlige sagsbehandlingstider for udstedelse af markedsføringstilladelser for modtagerlandssager
Se tabel 1-3 for CMS sager
Der findes en "best practice" aftale om, hvordan Lægemiddelstyrelsen giver markedsføringstilladelse i forbindelse med de MRP/DCP ansøgninger, hvor Danmark er modtagerland. Aftalen siger, at der bør være max. 30 dages sagsbehandlingstid, fra Lægemiddelstyrelsen modtager et acceptabelt nationalt produktresumé af det harmoniserede godkendte SPC, til vi giver en markedsføringstilladelse.
