Kliniske forsøg - spørgsmål og svar
På denne side vil vores spørgsmål/svar sektion løbende blive opdateret. I kan følge med i opdateringer i vores ændringslog i bunden af denne hjemmeside.
Spørgsmål/svar vedrørende kliniske lægemiddelforsøg under Forordningen
Definitioner på kliniske lægemiddelforsøg
1. Lægemiddelforsøg eller ej?
Hvilke kliniske forsøg skal Lægemiddelstyrelsen give tilladelse til?
Vi skal give tilladelse til kliniske forsøg med lægemidler og medicinsk udstyr, der ikke er CE mærket til det formål det afprøves til. (Læs mere om medicinsk udstyr her).
2. Hvad er et klinisk forsøg med et lægemiddel?
Jf. artikel 2 i klinisk forsøg forordningen er definitionerne som følger nedenfor.
Kliniske forsøg og kliniske lav-interventionsforsøg skal have tilladelse før igangsættelse.
1) »Klinisk undersøgelse«: enhver undersøgelse vedrørende mennesker, der har til formål:
a) at afdække eller efterprøve de kliniske, farmakologiske eller andre farmakodynamiske effekter af et eller flere lægemidler
b) at identificere bivirkninger ved et eller flere lægemidler, eller
c) at undersøge absorptionen, distributionen, metabolismen og udskillelsen af et eller flere lægemidler med henblik på at vurdere sikkerheden og/eller effekten af disse lægemidler.
2) »Klinisk forsøg«: en klinisk undersøgelse, som opfylder en af følgende betingelser:
a) forsøgspersonens udpegelse til en bestemt terapeutisk strategi afgøres på forhånd og følger ikke normal klinisk praksis i den berørte medlemsstat
b) beslutningen om at ordinere forsøgslægemidlet træffes sammen med beslutningen om at inddrage forsøgspersonen i den kliniske undersøgelse, eller
c) der anvendes diagnose- eller kontrolprocedurer ud over normal klinisk praksis over for forsøgspersonerne.
3) »Klinisk lav-interventionsforsøg«: et klinisk forsøg, som opfylder alle nedenstående betingelser:
a) forsøgslægemidlerne, bortset fra placebo, er godkendt
b) ifølge protokollen for det kliniske forsøg
- anvendes forsøgslægemidlerne i overensstemmelse med vilkårene i markedsføringstilladelsen, eller
- anvendelsen af forsøgslægemidler er evidensbaseret og understøttet af offentliggjort videnskabelig evidens for sikkerheden og effekten af disse forsøgslægemidler i en af de berørte medlemsstater
c) de ekstra diagnose- eller kontrolprocedurer udgør kun en minimal ekstra risiko eller byrde for forsøgspersonernes sikkerhed sammenlignet med normal klinisk praksis i en berørt medlemsstat.
4) »Ikke-interventionsundersøgelse«: en klinisk undersøgelse, der ikke er et klinisk forsøg.
3. Hvornår kan et lægemiddel defineres som et værktøj i forsøg?
Lægemidlet (værktøjet) er ikke genstand for undersøgelsen og anvendes som værktøj til at opnå et velkendt fysiologisk respons.
Eksempler:
- Pupiludvidende øjendråber anvendes for at undersøge øjets fysiologi
- Radioaktivt mærket sporstof (lægemiddel) ved en PET-scanning for at få et billede af f.eks. iltoptagelse eller glukoseomsætning i kroppen
- Der afdækkes/ efterprøves IKKE terapeutisk, diagnostisk eller forbyggende effekt eller sikkerhed af lægemidlet (værktøjet).
- Der indsamles IKKE data vedrørende lægemidlets farmakologiske virkninger herunder farmakodynamik og/eller –farmakokinetik.
Et klinisk forsøg, hvor lægemiddel/lægemidler udelukkende bruges som værktøj, skal ikke anmeldes til Lægemiddelstyrelsen. Læs mere om lovgivningen.
4. Skal jeg anmelde forsøg hvor lægemiddel/lægemidler anvendes som værktøj til Lægemiddelstyrelsen?
Nej, denne type forsøg er ikke omfattet af ansøgningspligten.
5. Kan jeg få en vurdering af, om Lægemiddelstyrelsen skal give tilladelse til et specifikt forsøg?
Hvis du er i tvivl om, hvorvidt et klinisk forsøg skal anmeldes til Lægemiddelstyrelsen, kan du sende en forespørgsel om ansøgningspligten.
Forespørgslen skal indeholde protokollen for forsøget og data om det præparat, der ønskes undersøgt. Hvis protokollen ikke er færdig, kan vi vurdere det ud fra en synopsis, hvor formål, effektmål og beskrivelse af hvordan de opnås, skal fremgå. Du kan sende din forespørgsel via dette link: Forespørgsel om klinisk forsøgs-klassifikation.
Hvis der er tvivl om, hvorvidt stoffet, der skal afprøves, er et lægemiddel eller ej, kan du hente hjælp her: Afgrænsning mellem lægemidler og andre produkter.
Krav til dokumenter
1. Hvor kan jeg se, hvilke dokumenter der skal indsendes?
I forordningens annex 1 er der listet hvilke dokumenter der skal indsendes.
De Videnskabsetiske Medicinske Komitéer har også lavet en Q&A-side for CTR/CTIS, hvor de svarer på en lang række spørgsmål omkring krav til indsendelse.
2. Er der retningslinjer for navngivning af dokumenter?
Dokumenter, der uploades I CTIS portalen må ikke indeholde dato og versionsnummer i filnavnet.
I stedet henvises til “Instruction Naming Documents”.
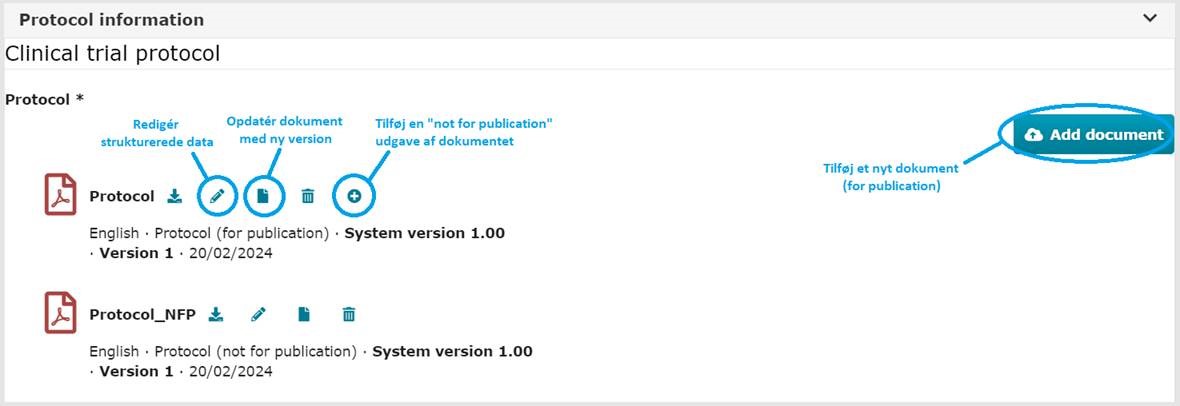
3. Hvordan indsender og opdaterer jeg dokumenter i CTIS?
3 a) Indsendelse af dokumenter:
Kan gøres ved enten initialansøgning, substantial modification eller non-substantial modification. Dokumenterne uploades enten under de sektioner de tilhører eller under fanen ”All documents”. Første upload af hver type dokument (Cover Letter, Protokol, m.m.) vil som hovedregel uploades ”for publication”. Disse bliver altså offentligt tilgængelige ved publicering og bør ikke indeholde sensitive oplysninger. Dog vil nogle typer dokumenter altid blive uploadet ”not for publication” – såsom IMPD. Find flere oplysninger om dette, på side 12 i The GCP Units guide to CTIS (overall guideline).
Fra november 2023 blev der indført reviderede regler for transparens.Dette betyder at det fremover kun vil være strukturerede data, protokol, synopsis og patientinformation der offentliggøres. De nye regler er dog ikke implementeret i CTIS endnu, hvorfor vi henviser til punkt 4 i denne Q&Ader beskriver hvordan sponsorer skal forholde sig i mellemtiden. Ændringerne i CTIS forventes at blive implementeret i 2. kvartal af 2024.
Husk at sørge for at de strukturerede data i CTIS (Titel, sprog, version og dato), stemmer overens med det faktiske indhold af dokumentet. Version og dato bør ikke fremgå af dokumentets titel, men kun i de strukturerede data - se evt. CTCG best practice guide naming of documents.
4 b) Opdatering af dokumenter:
Ved upload af nye versioner af eksisterende dokumenter, anvendes ”Update”-knappen (papir ikonet) ud for det eksisterende dokument.
5. Hvilke oplysninger skal forsøgsprotokollen indeholde?
Lægemiddelstyrelsen har lavet en template for forsøgsprotokoller (på engelsk som Word-fil), der beskriver hvilke oplysninger der skal fremgå af en protokol for at overholde kravene i forordningens annex 1, afsnit D samt the International Council for Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) M11 template
6. Hvilke oplysninger skal fremgå af følgebrevet (cover letter) ved indsendelse af ansøgning?
Følgebrevet skal, jf. bilag 1, afsnit B i forordningen, indeholde kerneoplysninger om forsøget såsom EU-forsøgsnummer, protokolkode/nummer, titel og sponsor. Det skal fremgå af følgebrevet, hvem sponsor har uddelegeret GCP-monitoreringen af forsøget til og det skal bekræftes, at monitor forstår dansk. Faktureringsoplysninger kan nævnes i følgebrevet eller uploades som et særskilt dokument i sektionen ”Proof of payment”. Der skal være en liste over alle forsøgslægemidler og hjælpelægemidler i forsøget, med angivelse af deres regulatoriske status (markedsført eller ej). Det skal angives hvor I ansøgningen at referencesikkerhedsdokumenterne (RSI) for de enkelte forsøgslægemidler findes.
Er der nogen særlige omstændigheder ved forsøgets design, forsøgslægemidler eller population, skal det også fremgå af følgebrevet, såsom first-in-human forsøg, decentrale forsøg, forsøg på børn eller særligt sårbare populationer m.fl. For en udførlig liste henviser vi til bilag 1, afsnit B i forordningen, der beskriver krav til indhold af følgebrevet.
Ved en eventuel re-submission skal det oplyses hvilke ændringer der er foretaget i den forbindelse.
7. Skal jeg stadig sende min ansøgning til Lægemiddelstyrelsen og det Videnskabsetiske Komité System efter forordningen er trådt i kraft?
Den kliniske forsøgsansøgning behandles hos både os og det Videnskabsetiske Komité System ved indsendelse i den nye EU-portal. Derfor skal der ikke indsendes ansøgninger direkte til Lægemiddelstyrelsen eller det etiske komitésystem. Dette gælder dog kun for lægemiddelforsøg.
8. Hvilke dokumenter skal indsendes på dansk?
I Annex II til EU-Kommissionens spørgsmål og svar dokument fremgår hvilke dokumenter der kan indsendes på dansk eller engelsk for Part I. Spørgsmål og svar dokumentet findes under Chapter V - Additional documents i den opdaterede EudraLex Volume 10 til forordningen.
9. Skal de samme dokumenter uploades flere gange?
Fremadrettet kan det skabe problemer i CTIS portalens struktur, hvis det samme dokument er uploadet i flere sektioner. I stedet kan det aktuelle dokument uploades i én sektion og et blankt dokument med reference, uploades i de øvrige sektioner.
10. Skal forsøg der kun skal foregå i Danmark (danske mononationale forsøg, inklusive forsøg fra non-kommercielle sponsorer) indsendes gennem EU portalen?
Alle lægemiddelforsøg skal indsendes gennem EU portalen.
18. Skal alle indsendelser ske gennem portalen, fx årlige sikkerhedsrapporter?
Alle indsendelser i løbet af forsøgets levetid inklusive notifikationer, væsentlige ændringer, årlige sikkerhedsrapporter, afsluttende rapport og resultater skal ske gennem portalen. En undtagelse er dog SUSARS som skal sendes direkte til EudraVigilance databasen. EMA har udarbejdet vejledning og organiseret træning.
19. Er det muligt at henvise til kvalitetsdokumentation fra andre forsøg eller henvise til kvalitetsdokumentation der indsendes separat af fremstiller, for at sikre konfidentialitet?
Det er muligt at henvise direkte til et andet forsøg, der er godkendt under forordningen eller allerede overført til CTIS, hvor den samme kvalitetsdokumentation er vurderet. Alternativt er der aftalt en procedure, hvor fremstilleren kan indsende kvalitetsdokumentationen (IMPD-Q) separat i CTIS. Begge disse scenarier er beskrevet under spørgsmål 2.15 i EU Kommisionens spørgsmål/svar-dokument under Chapter V - Additional documents i den opdaterede EudraLex Volume 10 til forordningen.
20. Hvad skal jeg være opmærksom på, hvis mit forsøg er et genterapiforsøg?
Patientforsøg med præparater, der indeholder levende, genetisk modificerede organismer, er omfattet af "lov om miljø og genteknologi", specielt lovens regler om forskning. Reglerne fremgår af Arbejdsministeriets bekendtgørelse (nr. 910 af 11. september 2008) om "genteknologi og arbejdsmiljø".
Bekendtgørelsen omfatter bl.a. krav til anmeldelse om klassifikation af lokaler, hvori hele eller dele af forsøget skal foregå, samt anmeldelse af projekter. Anmeldelserne sker for at sikre både arbejdsmiljøet og det ydre miljø. Arbejdstilsynet giver herefter en godkendelse af både lokaler og forsøg.
Der er indgået en samarbejdsaftale mellem Arbejdstilsynet og Miljøstyrelsen om behandling af visse anmeldelser om klassifikation af lokaler og anmeldelse af forskningsprojekter. Dette har ført til følgende praksis:
Anmeldelser om klassifikation af lokaler til genterapi og anmeldelse af projekter om anvendelse af levende, genetisk modificerede mikroorganismer til genterapi indsendes til Arbejdstilsynet, der så sender en kopi af anmeldelserne til høring i Miljøstyrelsen.
Lægemiddelforsøg med genterapi skal jf. ovenstående anmeldes til Arbejdstilsynet. Dette kan ske parallelt med ansøgningen til Lægemiddelstyrelsen.
Nærmere oplysninger om anmeldelser kan indhentes ved kontakt til Arbejdstilsynet (eller tlf. 39 15 20 00).
Clinical Trial Information System (CTIS)
EU-portalen (CTIS)
1 a) Hvordan skal jeg ansøge i EU-portalen (CTIS)?
Vi vil henvise til træningsprogrammet fra EMA. Her gennemgås alle trin ved video og vejledninger. Endvidere har GCP-enheden udarbejdet en CTIS-vejledning og EMA har udarbejdet Sponsors Handbook.
1 b) Hvor skal sponsor registreres for at anvende EU-portalen (CTIS)?
Sponsor skal være registreret i EMAs system til registrering af organisationer (OMS=Organizational Management Service”), nærmere information herom kan findes på EMAs hjemmeside med information vedrørende træningog forberedelse til anvendelse af CTIS.
1 c) Er der i Danmark krav om registrering af Legal Repræsentant i CTIS-portalen?
Hvis Sponsor er bosiddende i et land udenfor EU, er det krav i Lov om Kliniske Forsøg med lægemidler §21, at der registreres en Legal Repræsentant med bopæl i EU i CTIS. Det er ikke tilstrækkeligt at ”Contact point for union” er bosiddende i EU.
1 d) Hvordan tilknytter jeg forsøgslægemidler og placebo i CTIS-portalen i forbindelse med ansøgning om et nyt klinisk forsøg? OBS: Siden er under udarbejdelse.
Alle lægemidler/substanser, der anvendes i forsøget, skal være registreret i EMAs Extended EudraVigilance Medicinal Product Dictionary (XEVMPD), hvorefter det kan tilknyttes forsøget i CTIS. Placebo-produkt kan dog også tastes direkte i CTIS. For de lægemidler, der er registreret i XEVMPD, skal man for udviklingsprodukter kende EU MP number og EU substance number, for at kunne lave tilknytningen til forsøget i CTIS. Markedsførte produkter kan fremsøges fra CTIS vha. flere søgekriterier.
1 e) Hvordan skal jeg håndtere dokumenter med signatur i CTIS?
Såfremt man indsender signerede dokumenter (fx QP deklaration), skal disse uploades i en version ”not for publication” i tillæg til den version, der uploades ”for publication”. Se vejledning fra ACT EU:
1 f) Hvor kan jeg se sagsbehandlingstiderne for min ansøgning?
I CTIS findes der en "Timetable" under den enkelte ansøgning (for initial ansøgning og efterfølgende ændringsansøgninger (substantial modifications). Denne timetable er automatisk genereret, og tager højde for fri- og helligdage i de berørte medlemslande. Samtidig er det værd at bemærke, at nogle frister er dynamiske da de f.eks. afhænger af hvornår vurderingen hos myndighederne er færdig. I kan læse mere om tidsfrister for ansøgninger i EMAs vejledning til CTIS Evaluation Timelines.
1 g) Hvor kan jeg se om mit forsøg er godkendt i CTIS og hvilke versioner af dokumentationen der er godkendt?
Lægemiddelstyrelsen udsender ikke godkendelsesbreve for kliniske forsøg, da alt information om godkendelse af forsøget fremgår af CTIS. De godkendte versioner af forsøgsdokumentationen fremgår af den endelige assessment rapport, i henholdsvis Introduction og Conclusion afsnittene. Derudover kan sponsor downloade de strukturelle data fra CTIS som PDF-fil, hvori man kan finde navn på produkter samt estimeret end-of-trial dato. EMA's Step-by-step guide - How to search, view and download a CT and a CTA (Sponsors) viser hvordan man kan downloade struktureret data (på side 4). Herefter kan man så klippe siden med end-of-trial dato ud af PDF-filen, hvis man ikke ønsker at dele yderligere oplysninger.
2. Overgangsordning (transition)
Hvordan overfører jeg mit igangværende forsøg til forordningen?
For forsøg der skal overgå til forordningen, anbefaler vi, at læse videre her.
3. Subtantial Modifications (amendments) og underretninger
3 a) Er det stadig muligt at indsende en ny substantial modification, når jeg allerede har en modification under sagsbehandling i CTIS?
For indsendelse af Substantial Modifications i CTIS, anbefaler vi, at læse videre her: Substantial Modifications.
3 b) Hvilke krav gælder for underretning i CTIS portalen før, under og efter forsøget?
Medlemslandene skal notificeres om følgende i CTIS-portalen:
- Forsøgets start
- Start af rekruttering
- Afslutning af rekruttering
- Afslutning af forsøg (nationalt og globalt)
- Forventet dato for publicering af Summary of Results
- Tredjelandsinspektioner
Hvis der opstår sikkerhedsmæssige hændelser, fx Temporary halt, Urgent Safety Measures, Unexpected Events eller lignende, skal Sponsor underrette medlemslandene i CTIS.
Vejledning findes i Sponsors Handbook, afsnit 7.1.2.
4. Transparens
Hvor meget bliver offentliggjort i EU-portalen og databasen (CTIS)?
I overensstemmelse med de reviderede CTIS transparency regler (Revised CTIS transparency rules), som uploades i EU-databasen, der offentliggøres. Det har blandt andet til formål at beskytte personoplysninger og kommercielt fortrolige oplysninger. Indtil CTIS er tilpasset de reviderede CTIS transparency regler henvises der til ECT EU Q&A on the protection of Commercially Confidential Information and Personal Data while using CTIS ( Q&A on protection of confidential information and personal data in CTIS)
Generelt skal al inklusion af persondata minimeres og såfremt der inkluderes persondata i dokumentversion ”for publication”, skal disse anonymiseres med få undtagelser, hvor informationen er påkrævet at blive publiceret.
5. Re-submission
Hvordan indsendes en re-submission i CTIS?
En eventuel re-submission ansøges i CTIS ved hjælp af ”re-submission”-funktionaliteten på det eksisterende EU CT forsøgsnummer. Det skal fremgå af cover letter at der er tale om en re-submission.
Vi anbefaler at man, i alle uploadede dokumenter indeholdende EU CT nummer, fjerner de to sidste cifre i nummeret, da disse ændre sig ved hver re-submission. På denne måde undgår man at skulle opdatere dette nummer igen, ved evt. ny re-submission.
Man kan med fordel, ved re-submission, lave de rettelser der blev stillet considerations om ved initial indsendelse af forsøget. Man skal blot huske at adressere disse ændringer i cover letter, og tydeliggøre hvor i dokumentationen opdateringerne findes. Herudover skal opdaterede dokumenter uploades i både en clean version og track changes version.
For vejledning til resubmission se EMA’s FAQ, punkt 6.5 og Rapportering af SUSARs og årlige sikkerhedsrapporter
For rapportering af sikkerhedsmæssige indberetninger anbefaler vi at læse videre her: ”Sikkerhedsrapportering”
GCP-afvigelser
GCP-afvigelser
Hvilke krav gælder for rapportering af GCP-afvigelse (serious breaches)?
Jf. EU-forordningen vil der også være krav om at rapportere alvorlige GCP-afvigelser (læs definition på vores side vedr. alvorlige afvigelser). Fremover skal alvorlig afvigelse fra protokol/forordning rapporteres i EU-portalen, I kan se mere i modul 5 under Sponsor Workspace i EMAs online træning.
Andre emner
Kan man deltage i flere kliniske forsøg på samme tid?
Det er den kliniske forsøgsprotokol der skal tage stilling til, hvorvidt inklusion i forsøget kan tillades ved samtidig behandling i et andet klinisk forsøg.
I nogle protokoller er der inkluderet et standardeksklusionskriterie, som udelukker inklusion af individer der allerede deltager et andet klinisk forsøg. Nye typer af forsøgsdesigns, fx lav-interventions clusterforsøg (hvor forsøgslægemidlerne har en markedsføringstilladelse, såsom influenzavaccination), kan udfordre denne type af generel eksklusion, da de nye lav-interventions forsøgsdesign kan inkludere meget store populationer, som derved sætter en væsentlig begrænsning for rekruttering. Det bør derfor overvejes, at eksklusionskriteriet for deltagelse i andre forsøg er fleksibelt og vurderes ad hoc.
Det er vores vurdering, at der er tale om en non-substantiel ændring hvis en forsøgsprotokol opdateres med et fleksibelt eksklusionskriterie for at imødekomme ovenstående udfordring.
Hvad skal jeg gøre, hvis jeg ønsker, at DK påtager sig rollen som RMS?
Krav til indsendelse
Det er vores generelle tilgang, at vi gerne vil påtage os opgaven som RMS, når en sponsor foreslår os i CTIS.
Man behøver således ikke at sende mail på forhånd, da vi vil gøre vores bedste for at imødekomme ønsket. Der kan dog være perioder hvor vi er nødsaget til at afslå, f.eks. såfremt vi har mange forsøg, der modtages i samme periode.
Hvordan skal jeg indsende min ansøgning efter forordningen er trådt i kraft?
Under EU forordningen om kliniske forsøg med humanmedicinske lægemidler, skal alle forsøg ansøges i et fælles europæisk system (CTIS). Det betyder, at al information om forsøg i EU er samlet ét sted. Ved forsøg, der ønskes gennemført i flere lande, samarbejder de berørte landes myndigheder om vurderingen. På nationalt plan koordinerer Lægemiddelstyrelsen og etiske komiteer en samlet afgørelse.
Hvor kan jeg læse mere om Scientific Advice?
Læs mere på Lægemiddelstyrelsens side: Videnskabelig rådgivning (scientific advice) om lægemidler
Spørgsmål/svar vedrørende kliniske lægemiddelforsøg under Direktivet
Spørgsmål/svar i forbindelse med ansøgning om kliniske lægemiddelforsøg under direktivet
1. Ændringer/Amendments
1 a) Hvilke ændringer er væsentlige (substantial amendments)?
Se vores liste over 'hvilke ændringer der anses som væsentlige': Ændringer til kliniske forsøg.
1 b) Hvornår er en revideret Investigators Brochure et substantial amendment?
Kun i de tilfælde hvor risk-benefit vurderingen ændres.
Yderligere beskrivelse af hvad Investigators Brochure skal indeholde, kan du finde i ICH GCP Guideline.
2. Hvordan bliver mit forsøg registreret i EU Clinical Trials Register?
EU Clinical Trials Register opfylder kravene fra den internationale komité af redaktører af medicinske tidsskrifter (ICMJE), der kræver, at kliniske forsøg skal være forhåndsregistreret i en anerkendt offentlig database, før redaktørerne kan acceptere artikler om forsøget til offentliggørelse.
For forsøg godkendt under direktivet, henter EU Clinical Trials Register oplysninger fra EudraCT ansøgningsskemaet, der skal indsendes i forbindelse med ansøgning om tilladelse til forsøget hos Lægemiddelstyrelsen. Når vi har registreret, at der er tilladelse til et forsøg fra både Lægemiddelstyrelsen og det videnskabsetiske komitésystem i databasen, vil data om forsøget blive offentliggjort.
For forsøg godkendt under direktivet og som ikke overføres til klinisk forsøg forordningen (link til transition) er der stadig krav om at resultaterne for disse forsøg skal registreres i EudraCT. EudraCT vil stadig være tilgængeligt for upload af resultater.
Se mere om EU Clinical Trials Register.
3. Hvor kan jeg finde oplysninger om kliniske forsøg med lægemidler i Danmark?
Alle forsøg godkendt under direktivet i EU kan findes i den fælles europæiske database over kliniske forsøg i EU: EU Clinical Trials Register Man kan søge på forsøg i Danmark ved at skrive ’Denmark’ i søgefeltet. Den europæiske lægemiddelstyrelse (EMA) som hoster denne database har udarbejdet en vejledning til mere specifik søgning.
Forsøg godkendt under forordningen kan findes i Clinical Trials Information System (CTIS).
4. Hvordan skal jeg rapportere mine resultater til Lægemiddelstyrelsen?
For forsøg godkendt under direktivet, skal forsøgsresultater indtastes i EudraCT snarest muligt og senest inden 1 år efter forsøgets afslutning. Data vil herefter blive offentliggjort på EU Clinical Trials Register. Dette erstatter, at forsøgets resultater skal indsendes til os. Man kan læse mere på EudraCT hjemmesiden under ’update’ og generelt om afslutning af forsøg i vores vejledning afsnit 13. De offentlige GCP-enheder har lavet en vejledning, som kan findes her.
Forsøg godkendt under direktivet og som ikke overføres til klinisk forsøgsforordningen er der stadig krav om at resultaterne for disse forsøg skal registreres i EudraCT. EudraCT vil stadig være tilgængelig for upload af resultater.
5. Hvordan fremsøger jeg de forsøg, hvor der ikke er offentliggjort resultater i EudraCT/clinicaltrialsregister.eu?
Man kan søge på EU Clinical Trial Register på fx det relevante sygehus. Her fremgår det hvilke forsøg (Trial protocol, DK) der er registreret som afsluttede (completed) og hvis der mangler resultater, er der anført Trial results: No results available
(Man skal dog være opmærksom på at afdeling mv. skal være stavet korrekt i det oprindelige EudraCT skema for at kunne fremsøges. Det kan derfor være en fordel, ikke at søge for specifikt).
6. Hvilke krav gælder for sammensætningen af forsøgspersoner i kliniske forsøg?
Der er ikke faste standarder eller krav til fordelingen af forsøgspersoner ift. køn, alder, etnicitet eller helbredsprofil, eftersom sammensætningen af forsøgspersoner i et klinisk forsøg afhænger af, hvilke målgrupper det konkrete lægemiddel og dets indikation er rettet imod. Lovgivningen tilsiger dog, at det altid skal retfærdiggøres, hvis forsøgets protokol indeholder eksklusionskriterier, som kan medvirke til en skævvridning i fordelingen af forsøgspersoner. Dette understøttes af EMA’s retningslinjer, som fastslår, at der skal være en rimelig fordeling af forsøgspersoner, og når lægemiddelmyndighederne som led i godkendelsesprocessen vurderer resultaterne af kliniske forsøg, ser man nøje på, om der er tilstrækkelig dokumentation for effekt og bivirkninger hos specifikke målgrupper. Det skal derfor være klart beskrevet og dokumenteret i ansøgningen, at sammensætningen af forsøgspersoner er repræsentativ, så resultaterne bliver dækkende for alle relevante modtagergrupper.
Ændringslog:
18. december 2023 - Spørgsmålet ’Virtuelle/telemedicinske forsøg’ udgået. Tilføjet 'Deltagelse i flere kliniske forsøg på samme tid'.
07. oktober 2022 - Rettet links vedr. forsøgslægemidler, tilføjet henvisning til GMP-vejledning og tilføjet tekst øverst vedrørende den nye EU-forordning for kliniske forsøg.
16. april 2024 - Generel opdatering i forbindelse med overgang til EU-forordningen for kliniske forsøg.