Produktfejl og tilbagekaldelse af lægemidler i 2006
Indledning
Antal indberettede produktfejl
Fordeling af indberetningerne på kilder
Fejltyper
Forfalskede lægemidler
Specifikationsafvigelser
Tilbagekaldelser
Indberetninger i forhold til tidligere år
Der var i 2006 flere indberetninger om produktfejl, end der var i 2005. Indberetningerne omfattede både markedsførte og ikke-markedsførte lægemidler, herunder magistrelle lægemidler, der fremstilles efter lægeordination.
Indledning
Lægemiddelstyrelsen skal informeres, hvis en virksomhed skønner, at en produktfejl kan føre til tilbagekaldelse af et lægemiddel fra markedet. Dette fremgår af § 30 i bekendtgørelse nr. 1242 af 12. december 2005 om fremstilling og indførsel af lægemidler og mellemprodukter. Vi modtager også meddelelser om produktfejl på lægemidler fra udenlandske lægemiddelmyndigheder via det såkaldte ”Rapid Alert System”.
Lægemiddelstyrelsen foretager en grundig behandling af disse indberetninger som bl.a. omfatter en vurdering af alvoren af produktfejlene. Før der træffes beslutning om tilbagekaldelse af et lægemiddel, er der flere forhold, som skal undersøges. Blandt andet om lægemidlet er markedsført i Danmark, om det er under klinisk afprøvning eller udleveret via specialudleveringstilladelse. Endvidere kan lægemidlet være eksporteret fra Danmark.
Hvis de fejlbehæftede lægemidler er på det danske marked, eller hvis de er eksporteret, foretager vi sammen med virksomheden en tilbagekaldelse. Det vurderes, hvor langt ud i distributionskæden lægemidlet skal tilbagetrækkes (grossist, apotek, forbruger), og om det er relevant at informere andre lægemiddelmyndigheder om tilbagekaldelsen. Ved alvorlige produktfejl vil vi desuden advare om det på vores hjemmeside. Ved mindre kritiske produktfejl vurderes det desuden, hvordan en tilbagetrækning af lægemidlet vil påvirke forsyningen af lægemidler til den danske befolkning.
Virksomheder skal følge reglerne for god fremstillings- og distributionspraksis (GMP og GDP), som bidrager til at mindske fejlmulighederne under fremstilling og distribution af lægemidler. Vi kontrollerer ved inspektioner, om virksomhederne overholder disse regler. Lægemiddelstyrelsen hjemtager desuden løbende udvalgte lægemidler og kontrollerer pakning og etiket samt analyserer lægemidlerne. Ved sagsbehandling af variationsansøgninger til markedsføringstilladelser, kan oplysninger afdække fejl eller ændringer i lægemidler. Tilbagekaldelse af lægemidler kan derfor også ske i forbindelse med Lægemiddelstyrelsens kontrol og godkendelse af lægemidler eller ved inspektion af virksomhederne.
Der er i år foretaget nogle ændringer i forhold til rapporterne fra tidligere år. Under afsnittet med fejltyper har vi valgt at sætte fokus på forfalskede lægemidler og specifikationsafvigelser samt at beskrive tilbagekaldelserne i disse tilfælde, idet Lægemiddelstyrelsen de senere år har modtaget et stigende antal meddelelser om forfalskede lægemidler i EU. Vi modtager desuden hvert år et større antal meddelelser om lægemidler, der ikke holder specifikationerne.
Antal indberettede produktfejl
Der blev i 2006 indberettet i alt 196 sager om produktfejl ved lægemidler. Antal indberetninger i perioden 2003-2006 ses i figur 1. I 2006 har der været en markant stigning i antallet af indberetninger i forhold til de foregående år.
Figur 1. Antal indberetninger af produktfejl 2003-2006
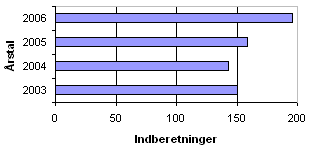
De 196 indberetninger om produktfejl i 2006 dækker:
- Indberetning af produktfejl fra virksomheder og myndigheder (> 90 % af indberetningerne)
- Reklamationer fra lægemiddelbrugere
- Fund af forfalskede lægemidler, som ikke er fremstillet af en godkendt lægemiddelfremstiller, og hvor kvalitet, effekt og sikkerhed ikke er dokumenteret
- Fund af kosttilskud/naturprodukter, der indeholder aktive lægemiddelstoffer
Indberetningerne omfatter både markedsførte og ikke-markedsførte lægemidler, herunder magistrelle lægemidler, der fremstilles efter lægeordination.
Fordeling af indberetningerne på kilder
Fordelingen af kilderne til de 196 indberetninger i 2006 ses nedenfor i figur 2.
Figur 2. Fordeling af indberetninger på kilder
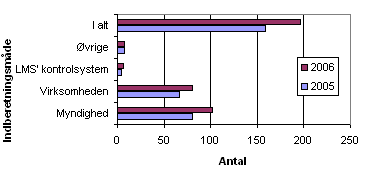
I 2006 var der flere indberetninger fra andre lægemiddelmyndigheder og fremstillere eller importører, end der var i 2005. Antallet af indberetninger i form af brugerreklamationer (kategori: øvrige) og Lægemiddelstyrelsens (LMS) kontrol/godkendelse var stort set det samme som i 2005.
Fejltyper
Indberetningerne bliver ved registrering i Lægemiddelstyrelsen fordelt på seks forskellige fejltyper. Fordelingen ses nedenfor i figur 3.
Figur 3. Fordeling på fejltyper
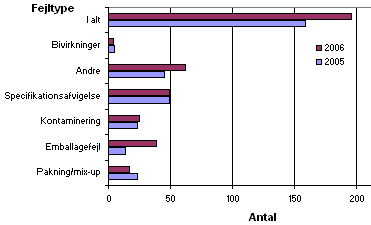
I forhold til 2005 er der i 2006 observeret færre fejl vedrørende pakning og mix-ups, hvorimod der var en stigning i antallet af 'andre afvigelser' (f.eks. forfalskede lægemidler) og fejl vedrørende emballage i 2006 i forhold til 2005. Emballagefejlene ses ofte ved ompakning af lægemidler. Antallet af fejl ved kontaminering, specifikationsafvigelser og bivirkninger var stort set på samme niveau som i 2005.
Forfalskede lægemidler
Via rapid alert systemet har vi set et stigende antal advarsler om forfalskede lægemidler i det legale distributions netværk i perioden 2003-2006, jf. tabel 1. Der er dog på nuværende tidspunkt ikke set forfalskede lægemidler i det legale distributionsnetværk i Danmark.
Tabel 1. Antal forfalskede lægemidler i perioden 2003-2006
|
2003 |
2004 |
2005 |
2006 |
Forfalskede lægemidler |
0 |
2 |
3 |
8 |
Specifikationsafvigelser
Blandt de 49 indberetninger om fejl ved specifikationsafvigelser, blev der i 18 tilfælde tilbagekaldt i Danmark, som fordelte sig på følgende årsager:
- Ændret holdbarhed (fem tilbagekaldelser)
- Det faktiske indhold af lægemiddelstof afviger fra det deklarerede (fem tilbagekaldelser)
- Udfældning og udkrystallisering (tre tilbagekaldelser)
- Utætheder (to tilbagekaldelser)
- Ændring af farve (én tilbagekaldelse)
- Manglende kontrol (én tilbagekaldelse)
- Ændret partikelstørrelse (én tilbagekaldelse)
Tilbagekaldelser
Af de 196 indberetninger resulterede 28% i tilbagekaldelser af lægemidler fra det danske marked
I forhold til 2005 og 2004 er dette en mindre andel af det samlede antal indberetninger, der resulterede i tilbagekaldelser, men der er dog ikke store afvigelser i forhold til 2003, jf. tabel 2.
Tabel 2. Antal tilbagekaldelser i perioden 2002-2006
|
2002 |
2003 |
2004 |
2005 |
2006 |
Antal indberetninger |
192 |
150 |
143 |
160 |
196 |
Antal tilbagekaldelser |
72 |
39 |
58 |
58 |
55 |
Tilbagekaldelser i procent |
38% |
26% |
41% |
36% |
28% |
Tabel 3. Fordeling af indberetninger der resulterede i tilbagekaldelser i 2005-2006
|
Antal i 2005 |
Antal i 2006 |
Virksomhed |
44 |
39 |
Udenlandsk myndighed |
11 |
10 |
Lægemiddelstyrelsens kontrolsystem |
2 |
2 |
Andre |
1 |
4 |
I alt |
58 |
55 |
I tabel 3 ses der små ændringer i 2006 i forhold til i 2005. Der var lidt færre indberetninger fra virksomhederne selv i 2006 end i 2005, mens antallet af indberetninger fra udenlandske myndigheder og Lægemiddelstyrelsens kontrolsystem var på samme niveau som i 2005. Det kan således konkluderes, at fordelingen samlet set ikke har ændret sig ret meget siden 2005.
Årsagerne til de 39 tilbagekaldelser foretaget efter virksomhedernes indberetning var hovedsagelig produktfejl i form af specifikationsafvigelser. Udover specifikationsafvigelser forekom der også andre fejl som f.eks. fejl ved emballage, kontaminering eller udfældning, m.m.
Tre af de ti tilbagekaldelser, som blev iværksat efter indberetning fra udenlandske myndigheder skyldtes specifikationsafvigelser, to skyldtes kontaminering og én skyldtes fejl i emballagen. De resterende fire skyldtes andre fejl.
Årsagerne til de to tilbagekaldelser initieret af Lægemiddelstyrelsen var specifikationsafvigelser.
Indberetninger i forhold til tidligere år
Der var i 2006 flere indberetninger om produktfejl i forhold til de tre foregående år, jf. figur 1. Der er i 2006 opstartet flere indberetninger fra andre lægemiddelmyndigheder og fra fremstillere eller importører end tidligere år.
Der er foretaget omtrent lige så mange tilbagekaldelser af fejlbehæftede lægemidler i Danmark og eksportlande, hvortil dansk fremstillede lægemidler er tilgået, som sidste år. Disse tilbagekaldelser skyldes hovedsageligt specifikationsafvigelser og fejl ved etiket, emballage eller indlægssedler.
Yderligere oplysninger kan fås ved henvendelse til Louise Rus Christensen, tlf. 44 88 97 58.
