Årsrapport fra Medicintilskudsnævnet 2008
Medlemmer udpeget af ministeren for sundhed og forebyggelse
17 møder i 2008
24 ansøgninger om generelt tilskud
Begrundelser
1527 ansøgninger om individuelle medicintilskud
Årlig vurdering af antallet af ansøgninger om enkelttilskud
Prisstigning efter opnåelse af generelt tilskud
Forslag vedrørende vacciner
Nordisk myndighedsmøde
Stormøde om medicintilskud
Revurdering af lægemidlers tilskudsstatus
Medicintilskudsnævnet rådgiver Lægemiddelstyrelsen i ansøgninger om tilskud til lægemidler. Det gælder både generelle tilskud til lægemidler (efter ansøgning fra lægemiddelvirksomheder) og individuelle tilskud til patienter (efter ansøgning fra læger). Nævnet rådgiver desuden Lægemiddelstyrelsen ved revurderinger af lægemidlers tilskudsstatus. Lægemiddelstyrelsen fungerer som sekretariat for nævnet.
Medlemmer udpeget af ministeren for sundhed og forebyggelse
Medicintilskudsnævnet har 6 medlemmer. Medlemmerne er udpeget af ministeren for sundhed og forebyggelse efter indstilling fra Lægemiddelstyrelsen på baggrund af forslag fra videnskabelige selskaber. Et medlem er udnævnt efter indstilling fra Regionernes Lønnings- og Takstnævn. Nævnets medlemmer udpeges for 4 år ad gangen, og de har tilsammen en bred faglig ekspertise. Habilitetserklæringer for nævnets medlemmer kan ses på www.laegemiddelstyrelsen.dk.
I 2008 bestod nævnet af:
Overlæge, dr. med. Mogens Laue Friis (formand)
Overlæge, dr. med. Karine Bech
Alment praktiserende læge Ellen-Christine Beiter
Centerdirektør, dr. med. Mogens Sandbjerg Hansen
Alment praktiserende læge John Larsen.
Udviklingschef Peder Ring (Danske Regioner)
17 møder i 2008
Medicintilskudsnævnet holdt 17 møder i 2008. Mødereferaterne kan læses på www.laegemiddelstyrelsen.dk.
24 ansøgninger om generelt tilskud
Medicintilskudsnævnet rådgiver Lægemiddelstyrelsen om ansøgninger om generelt tilskud efter de kriterier, som er fastsat i Bekendtgørelse nr. 180 af 17. marts 2005 om medicintilskud.
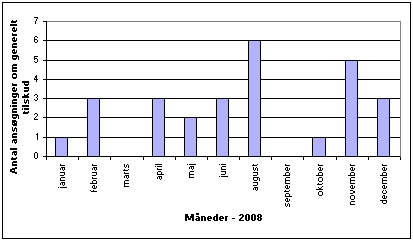
I 2008 behandlede Medicintilskudsnævnet 24 ansøgninger om generelt tilskud. 16 lægemidler blev indstillet til generelt tilskud uden klausulering, 2 lægemidler blev indstillet til generelt tilskud med klausulering, og 6 lægemidler blev indstillet til afslag. 4 af ansøgningerne var genansøgninger, heraf blev 1 lægemiddel indstillet til generelt tilskud. Derudover blev 2 ansøgninger udsat til et af de efterfølgende møder, fordi nævnet i det ene tilfælde havde behov for faglig udtalelse fra et relevant videnskabeligt selskab inden endelig stillingtagen til den aktuelle ansøgning. I det andet tilfælde ønskede nævnet en forbrugsanalyse baseret på tal fra Lægemiddelstyrelsens lægemiddelstatistikregister.
Antallet af ansøgninger om generelt tilskud, som nævnet behandlede på de månedlige møder, fremgår af figur 1.
Figur 1. Antal ansøgninger om generelt tilskud behandlet af nævnet pr. månedligt møde i 2008.
Begrundelser
Nævnets indstillinger i forbindelse med ansøgninger om generelt tilskud offentliggøres på Lægemiddelstyrelsens netsted. Indstillingerne til afslag har været begrundet i dels lægemidlernes pris sammenlignet med andre relevante lægemidler, dels risikoen for anvendelse af lægemidlerne som førstevalg uanset, at dette efter nævnets opfattelse ikke bør være tilfældet.
Indstillingerne til generelt tilskud har oftest været begrundet i, at den behandlingsmæssige værdi står mål med prisen sammenlignet med andre relevante lægemidler.
1527 ansøgninger om individuelle medicintilskud
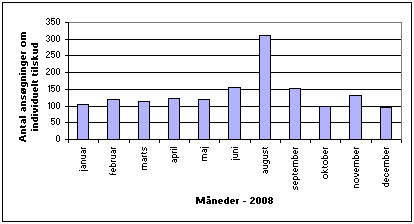
I 2008 modtog Lægemiddelstyrelsen 139.044 ansøgninger om individuelle medicintilskud. 1527 af disse ansøgninger blev forelagt for Medicintilskudsnævnet, fordi sekretariatet ikke umiddelbart mente, de kunne imødekommes. I 64 pct. af tilfældene indstillede nævnet, at ansøgningerne skulle imødekommes. Antallet af individuelle ansøgninger, som nævnet behandlede på de månedlige møder, fremgår af figur 2.
I forbindelse med behandling af ansøgninger om enkelttilskud drøfter nævnet jævnligt, om de vejledende kriterier for enkelttilskud for de forskellige lægemidler er i overensstemmelse med nyeste viden indenfor de relevante sygdomsområder. I løbet af året blev de vejledende enkelttilskudskriterier for lægemidler mod demens, osteoporose og blodpropsforebyggelse således opdateret.
Figur 2. Antallet af individuelle tilskudsansøgninger behandlet af nævnet pr. månedligt møde i 2008.
Årlig vurdering af antallet af ansøgninger om enkelttilskud
Lægemiddelstyrelsen udarbejder hvert år en status over antal ansøgninger om enkelttilskud i året, der er gået. På baggrund af denne status diskuterer nævnet fordelingen mellem imødekomne og afslåede ansøgninger inden for de respektive lægemidler/lægemiddelgrupper, herunder om udviklingen i antallet af ansøgninger er hensigtsmæssig. I 2008 indstillede nævnet - efter diskussion af ovenstående status - et blodfortyndende lægemiddel til generelt tilskud.
Udover det nævnte lægemiddel har nævnet indstillet yderligere 5 andre lægemidler til generelt tilskud i løbet af året, uden at lægemiddelvirksomhederne har ansøgt om det. Nævnet vurderede i alle tilfælde, at lægemidlerne nu opfylder kriterierne for generelt tilskud eller generelt klausuleret tilskud.
Prisstigning efter opnåelse af generelt tilskud
Et hurtigtvirkende NSAID lægemiddel var indtil sommeren 2007 ikke generelt tilskudsberettiget pga. dets høje pris sammenlignet med andre relevante lægemidler. Efter prisfald på dette lægemiddel tildelte Lægemiddelstyrelsen på eget initiativ lægemidlet generelt tilskud med virkning fra d. 18. juni 2007. Efter næsten et år med generelt tilskud gik lægemidlet af markedet i marts 2008, men kom tilbage på markedet igen i oktober 2008 til en pris, der lå på niveau med den pris, lægemidlet havde, da det ikke havde generelt tilskud. Dette svarer til en prisstigning på flere hundrede procent på et halvt år. Nævnet anbefalede herefter, at lægemidlet ikke længere skulle være tilskudsberettiget, fordi prisen ikke står i et rimeligt forhold til den behandlingsmæssige værdi, når lægemidlet sammenlignes med andre NSAID lægemidler.
Forslag vedrørende vacciner
Nævnets og Lægemiddelstyrelsens forslag om at flytte kompetencen for tildeling af tilskud til vacciner fra Lægemiddelstyrelsen til Sundhedsstyrelsen blev imødekommet i forbindelse med ændringen af sundhedsloven i begyndelsen af året. 1. maj 2008 fik Sundhedsstyrelsen kompetencen.
Nordisk myndighedsmøde
Mogens Laue Friis deltog i et nordisk myndighedsmøde, som blev afholdt i Helsingfors d. 22.-23. maj. Formålet med mødet var primært at orientere om emner af særlig interesse for pris- og tilskudsmyndighederne herunder en orientering fra de enkelte lande om, hvad der var sket på dette område siden sidste nordiske myndighedsmøde. På mødet var der bl.a. fokus på revurderingsprojekterne for de blodtrykssænkende lægemidlers tilskudsstatus i både Sverige og Danmark, og der blev drøftet muligheder for et evt. samarbejde omkring evaluering af de kliniske studier, som lægges til grund for revurderingerne.
Stormøde om medicintilskud
Mogens Laue Friis deltog som oplægsholder på Lægemiddelstyrelsens stormøde om medicintilskud d. 28. maj. I Indlægget blev der fortalt om nævnets arbejde, herunder hvad nævnet lægger vægt på, når det vurderer ansøgninger om generelt og individuelt tilskud og udarbejder indstillinger til Lægemiddelstyrelsen. Der deltog omkring 80 personer i mødet, størstedelen af deltagerne var fra lægemiddelindustrien og regionerne. I 88 % af de afgivne evalueringer blev indlægget bedømt som godt eller meget godt.
Revurdering af lægemidlers tilskudsstatus
Lægemiddelstyrelsen skal ifølge sundhedsloven løbende revurdere alle lægemidlers tilskudsstatus. Medicintilskudsnævnet udarbejder indstillinger med anbefaling om lægemidlers fremtidige tilskudsstatus til Lægemiddelstyrelsen.
I 2008 har nævnet drøftet tilskudsstatus for de blodtrykssænkende lægemidler – lægemidler i ATC-grupperne C02 (antihypertensiva), C03 (diuretika), C07 (betablokkere), C08 (calciumantagonister) og C09 (ACE-hæmmere, angiotensin-II antagonister og renin-hæmmere). Nævnet har afgivet to indstillinger om de blodtrykssænkede lægemidler. Den første indstilling blev sendt i høring hos berørte virksomheder, relevante videnskabelige selskaber, patientforeninger m.fl. d. 29. januar, og en supplerende indstilling blev sendt i høring d. 2. september. Nævnets indstillinger samt høringssvarene kan læses på www.laegemiddelstyrelsen.dk.
Lægemiddelstyrelsen, den 14. april 2009