Produktfejl og tilbagekaldelser af lægemidler i 2008
Indledning
Resumé af hovedfund i 2008
Indberetninger
- Antal indberettede produktfejl
- Fordeling af indberetningerne på kilder
- Fordeling af indberetninger på fejltyper
- Forfalskede lægemidler
Tilbagekaldelser
- Antal tilbagekaldelser
- Fordeling af indberetningskilder for tilbagekaldelser
Indledning
Lægemiddelstyrelsen skal via indberetninger informeres, hvis en virksomhed skønner, at en produktfejl kan føre til tilbagekaldelse af et lægemiddel fra markedet. Dette fremgår af § 30 i bekendtgørelse nr. 1242 af 12. december 2005 om fremstilling og indførsel af lægemidler og mellemprodukter.
Lægemiddelstyrelsen kan gennem det såkaldte ”Rapid Alert System” hurtigt modtage advarsler om produktfejl fra udenlandske lægemiddelmyndigheder og ligeledes meddele nye produktfejl på internationalt plan. Rapid Alert systemet omfatter udelukkende lægemidler i den legale distributionskæde.
Indberetningerne inddeles i klasse I, II og III efter hvor alvorlig defekten er. Klasse I defekter er potentielt livstruende, og kræver ”rapid alerts” udsendt til alle parter. Klasse II og III defekter kan udgøre en patientrisiko, og behandles herefter. Lægemiddelstyrelsens indberetninger for 2008 indeholder flest klasse I og II defekter. Udover Rapid Alert systemet, kan danske og udenlandske virksomheder indberette produktfejl, ved direkte at tage kontakt til lægemiddelstyrelsen.
Lægemiddelstyrelsen foretager en grundig behandling af alle indberetninger. Før der træffes beslutning om tilbagekaldelse af et lægemiddel, er der flere forhold, som skal undersøges. Blandt andet om lægemidlet er markedsført i Danmark, om det er under klinisk afprøvning eller udleveret via specialudleveringstilladelse, samt i hvilken grad produktfejlen udgør en potentiel patientrisiko. Endvidere kan lægemidlet være eksporteret fra Danmark.
Hvis de fejlbehæftede lægemidler er på det danske marked, eller hvis de er eksporteret, kan Lægemiddelstyrelsen i samarbejde med virksomheden foretage en tilbagekaldelse. Det vurderes, hvor langt ud i distributionskæden lægemidlet skal tilbagetrækkes (grossist, apotek, forbruger), samt hvorvidt det er relevant at informere andre lægemiddelmyndigheder om tilbagekaldelsen. Ved alvorlige produktfejl vil Lægemiddelstyrelsen desuden advare om det på hjemmesiden www.laegemiddelstyrelsen.dk. Ved mindre kritiske produktfejl, vurderes det desuden, hvordan en tilbagetrækning af lægemidlet vil påvirke forsyningen af lægemidler til den danske befolkning.
Virksomheder skal følge reglerne for god fremstillings- og distributionspraksis (GMP og GDP), som bidrager til at mindske fejlmulighederne under fremstilling og distribution af lægemidler. Lægemiddelstyrelsen kontrollerer ved eftersyn, om virksomhederne overholder disse regler. Desuden hjemtages løbende udvalgte lægemidler, pakninger, etiketter samt analyser til kontrol i Lægemiddelstyrelsens laboratorier. Ved sagsbehandling af variationsansøgninger til markedsføringstilladelser, kan indsendte oplysninger afdække fejl eller ændringer i lægemidler. Tilbagekaldelse af lægemidler sker derfor også i forbindelse med Lægemiddelstyrelsens egen kontrol og godkendelse af lægemidler, eller ved inspektion af virksomheder.
Resumé af hovedfund i 2008
Der blev i 2008 registreret 177 indberetninger om produktfejl ved lægemidler, hvilket er et fald i forhold til 2007. Af disse indberetninger, har 23 % resulteret i tilbagekaldelser fra det danske marked, og dette antal er ligeledes faldet i forhold til de foregående år. De fleste tilbagekaldelser foretaget i 2008 var indberettet af virksomheder. Den hyppigste årsag til tilbagekaldelser bestod af fejltypen ”emballagefejl”.
Indberetninger
Antal indberettede produktfejl
Der blev i 2008 indberettet i alt 177 sager om produktfejl på lægemidler. Antal indberetninger i perioden 2005-2008 ses af figur 1. Der er sket et fald i antallet af indberetninger i 2008 i forhold til de foregående år, hvor tallet har været stigende.
Fig. 1. Antal indberetninger af produktfejl 2005-2008
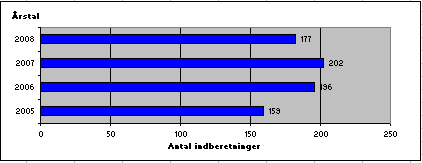
De 177 indberetninger om produktfejl i 2008 omfatter både markedsførte og ikke-markedsførte lægemidler. Indberetningerne dækker:
- Indberetning om produktfejl fra virksomheder og myndigheder (> 90 % af indberetningerne)
- Reklamationer fra lægemiddelbrugere
- Fund af forfalskede lægemidler i den legale kæde, der ikke er fremstillet af en godkendt lægemiddel-fremstiller, og hvor kvalitet, effekt og sikkerhed ikke er dokumenteret
- Indberetning om manglende overholdelse af GMP eller GDP hos virksomheder, som følge af inspektioner udført af europæiske lægemiddelmyndigheder
Fordeling af indberetningerne på kilder
Kilderne til de 177 indberetninger til Lægemiddelstyrelsen i 2008 sammenlignet med foregående år fremgår af figur 2.
Fig. 2. Fordeling af indberetninger på kilder
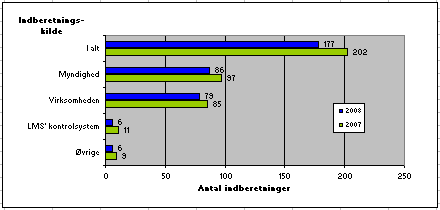
I 2008 var der generelt set færre indberetninger af produktfejl på lægemidler. Fra Lægemiddelstyrelsens kontrol/godkendelse ses et fald af indberetninger i forhold til 2007. Ligeledes har der været et mindre fald i antallet af indberetninger fra virksomheder (fremstillere og importører) og fra andre lægemiddelmyndigheder i forhold til 2007. Endvidere ses et lille fald i antallet af indberetninger fra øvrige kilder (patienter, læger og apoteker) i 2008 sammenlignet med 2007.
Fordeling af indberetninger på fejltyper
Indberetningerne bliver ved registrering i Lægemiddelstyrelsen fordelt på seks forskellige fejltyper.
Fordelingen i 2008 i forhold til 2007 ses nedenfor af figur 3. For en kort beskrivelse af de enkelte fejltyper se desuden boks 1.
Fig.3. Fordeling af indberetninger på fejltyper
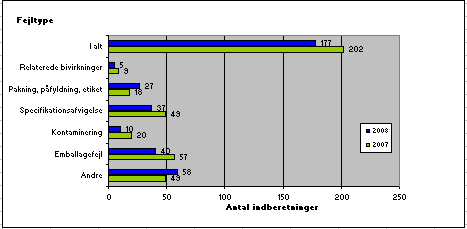
Der blev i 2008 i forhold til 2007 observeret en stigning i indberettede fejl i form af fejl ved ”Pakning, påfyldning og etiket” samt i kategorien ”Andre”. Derimod er antallet af fejl vedrørende bivirkninger, specifikationsafvigelse, kontaminering og emballagefejl faldet i forhold til 2007.
Boks. 1. Fejltyper
|
Via Rapid Alert systemet var der i perioden 2003-2007 modtaget et stigende antal advarsler om forfalskede lægemidler i det legale distributionsnetværk globalt. Dette antal er faldet markant i 2008 jvf. tabel 1. Lægemiddelstyrelsen har dog på nuværende tidspunkt ikke modtaget indberetninger om, eller observeret forfalskede lægemidler, i det legale distributionsnetværk i Danmark.
Faldet i antal indberetninger for 2008, kan dels skyldes færre observerede tilfælde af forfalskninger globalt, dels en faldende tendens i indberettede tilfælde til lægemiddelstyrelsen.
Tabel 1. Antal indberetninger om forfalskede lægemidler i perioden 2003-2008
|
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
Forfalskede lægemidler |
0 |
2 |
3 |
8 |
19 |
3 |
Som led i arbejdet med at forhindre, at forfalskede lægemidler når ud til forbrugerne, har Lægemiddelstyrelsen nedsat et netværksteam mod forfalskede lægemidler. Netværket omfatter myndigheder, brancheorganisationer, faglige organisationer og alle led i distributionen. Netværket mødes to gange årligt og diskuterer problemstillinger relateret til forfalskede lægemidler, hvor fra der igangsættes både lokale og tværgående forebyggelsesinitiativer.
Aktuelt udarbejder netværket en vejledning, der skal tjene som hjælp til lægemiddelvirksomheder og apoteker i bestræbelserne på at forebygge, at forfalskede lægemidler ender i den legale distributionskæde.
På Lægemiddelstyrelsens hjemmeside vil det om kort tid, være muligt for virksomheder at udfylde en elektronisk blanket med oplysninger til indberetning af forfalskede lægemidler. Dette med henblik på at forenkle indberetningsproceduren for de virksomheder, der er omfattet af indberet-ningspligten i lægemiddellovens § 43b (lov nr. 1180 af 12. december 2005). Indberetningspligten blev indført ved en ændring af lægemiddelloven den 1. juli 2008, og forpligter indehavere af en markedsføringstilladelse efter lovens § 7, og indehavere af en virksomhedsgodkendelse efter lovens § 39, stk. 1, til at indberette fund af forfalskede lægemidler til Lægemiddelstyrelsen.
Lægemiddelstyrelsen deltager i det europæiske samarbejde mellem lægemiddelmyndigheder i EU,
og modtager herigennem oplysninger om ulovlige, herunder forfalskede, lægemidler distribueret i den illegale distributionskæde i Europa. Det kan f.eks. være oplysninger om illegal internethandel med lægemidler, som grundet internettets globale natur, kan have relationer til mange lande. Lægemiddelstyrelsen undersøger sådanne oplysninger i forhold til, om der synes at være relationer til Danmark, der skal sanktioneres. Endvidere offentliggør vi advarsler på vores hjemmeside, hvis det skønnes nødvendigt at informere danske forbrugere. Er der forhold som kan sanktioneres efter den danske lægemiddellov, træffer Lægemiddelstyrelsen afgørelse over for de ansvarlige, og overdrager efter omstændighederne sådanne sager til politiet med henblik på idømmelse af straf for overtrædelse af lægemiddellovens regler.
Tilbagekaldelser
Af de 177 indberetninger til Lægemiddelstyrelsen vedrørende produktfejl i 2008, resulterede 23 % i deciderede tilbagekaldelser af lægemidler fra det danske marked.
Det samlede antal indberetninger er faldet i forhold til de to foregående år, 2006-2007, som det fremgår af tabel 2. Endvidere er antallet af tilbagekaldelser, samt den procentmæssige fordeling af tilbagekaldelser, faldet sammenlignet med de fire foregående år, 2004-2007.
Tabel 2. Antal tilbagekaldelser i perioden 2002-2008
|
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
Antal indberetninger |
192 |
150 |
143 |
160 |
196 |
202 |
177 |
Antal tilbagekaldelser |
72 |
39 |
58 |
58 |
55 |
57 |
41 |
Tilbagekaldelser i procent |
38% |
26% |
41% |
36% |
28% |
28% |
23% |
Fordeling af indberetningskilder for tilbagekaldelser
Af tabel 3 ses hvordan de 41 tilbagekaldelser i 2008 fordeler sig på diverse indberetningskilder.
Tabel 3. Fordeling af indberetninger der resulterede i tilbagekaldelser i 2006-2008
|
Antal i 2006 |
Antal i 2007 |
Antal i 2008 |
Virksomhed |
39 |
47 |
29 |
Udenlandsk myndighed |
10 |
4 |
8 |
Lægemiddelstyrelsens kontrolsystem |
2 |
5 |
3 |
Andre |
4 |
1 |
1 |
I alt |
55 |
57 |
41 |
I 2008 var der et forholdsmæssigt mindre antal tilbagekaldelser foranlediget af indberetninger fra virksomheder sammenlignet med 2007. Det samme er tilfældet for tilbagekaldelser, hvor produktfejlen var indberettet via lægemiddelstyrelsens kontrolsystem. Derimod blev der i forhold til 2007 observeret flere tilbagekaldelser ved indberetning fra udenlandske myndigheder. Kategorien ’andre’ (patienter, læger, apoteker) er uændret sammenlignet med 2007.
Årsagerne til de 41 tilbagekaldelser foretaget i 2008, var hovedsageligt af fejltypen ’emballagefejl’. Desuden tegnede produktfejl såsom ’andre afvigelser’ og ’pakning, påfyldning, etiket’ sig for en stor del af tilbagekaldelserne.
Af det samlede antal tilbagekaldelser, er ca. 10 % tilbagekaldt fra parallel importører/distributører.
Yderligere oplysninger kan fås ved henvendelse til Charlotte Henriksen, tlf. 44 88 92 51
