Rybelsus (oral semaglutid): Risiko for medicineringsfejl i forbindelse med introduktion af ny formulering med øget biotilgængelighed
| Produkt/aktiv substans | Sikkerhedskommunikation |
| Rybelsus (oral semaglutid) tabletter | Ny formulering med øget biotilgængelighed: Risiko for medicineringsfejl |
Resumé
• Rybelsus tabletter vil blive erstattet af en ny formulering med øget biotilgængelighed, der er bioækvivalent med den oprindelige formulering som beskrevet i nedenstående tabel:
| Oprindelig formulering (én oval tablet) | Bioækvivalent | Ny formulering (én rund tablet) |
| 3 mg (startdosis) | = | 1,5 mg (startdosis) |
| 7 mg (vedligeholdelsesdosis) | = | 4 mg (vedligeholdelsesdosis) |
| 14 mg (vedligeholdelsesdosis) | = | 9 mg (vedligeholdelsesdosis) |
• Den nye formulering har samme virkning, sikkerhed og administrationsmetode som den oprindelige formulering.
• Rybelsus skal altid anvendes som én tablet om dagen.
• De to formuleringer vil midlertidigt være tilgængelige på markedet samtidigt, hvilket kan forårsage forvekslinger. Dette kan resultere i overdosering, hvilket øger risikoen for bivirkninger. Den nye formulering introduceres 1. september 2025.
• Patienter, der i øjeblikket tager Rybelsus, skal informeres og rådgives om ændringen i formulering og dosis, når den nye formulering ordineres eller udleveres.
• Ordinering af den nye formulering kræver en ny ordination, og derfor kan det i en overgangsperiode være nødvendigt, at patienter der er i igangværende behandling med Rybelsus har to aktive ordinationer.
• Patienter, der starter i behandling med Rybelsus, skal have den nye formulering ordineret og informeres grundigt af den ordinerende læge eller apotekspersonalet.
Baggrund for sikkerhedsinformationen
Rybelsus er indiceret som supplement til kost og motion til behandling af voksne med type 2-diabetes mellitus, som ikke er tilstrækkeligt kontrolleret.
Novo Nordisk erstatter den oprindelige formulering (3 mg, 7 mg og 14 mg tabletter) af Rybelsus med den nye formulering (1,5 mg, 4 mg og 9 mg tabletter).
I sammenligning med den oprindelige formulering er hjælpestofferne i den nye formulering blevet modificeret for at øge absorptionen. Den nye formulering har øget biotilgængelighed, hvilket resulterer i lavere doser for at opnå den samme lægemiddeleksponering. Bioækvivalensen er blevet påvist i et klinisk studie, og doserne af den nye formulering har den samme virkning og sikkerhed som den oprindelige formulering. Det betyder, at de data, der blev genereret i det kliniske fase 3-studieprogram for Rybelsus, er gældende for den nye formulering. Dette tillader skift mellem tilsvarende doser af den oprindelige formulering og den nye formulering. Administrationsmetoden forbliver den samme.
Da begge formuleringer vil være tilgængelige samtidig i overgangsperioden, kan det potentielt føre til forvirring og udgøre en risiko for medicineringsfejl. Medicineringsfejl kan resultere i øget eksponering for semaglutid, hvilket kan give gastrointestinale bivirkninger; f.eks. kvalme, opkastning og diarré.
Produktinformationen er blevet opdateret for at forklare forskellen mellem de to formuleringer og gøre det muligt for læserne at identificere de ækvivalente doser på tværs af formuleringer med bioækvivalente doser.
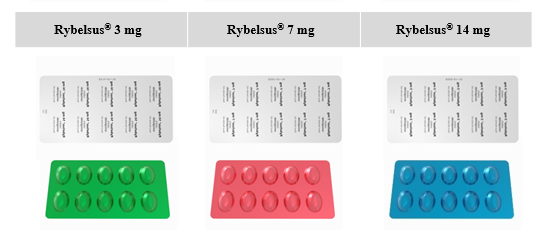
Pakningen og tabletformen for den nye formulering adskiller sig fra den oprindelige formulering, men farven på de forskellige doseringstrin forbliver den samme. Se tabellen nedenfor.
Tabletstørrelse:
Tabletterne i den nye formulering er mindre i størrelse og har en anden form (rund).
Tabletterne er præget med styrke.
Oprindelig vs Ny
Primær pakning:
Blisterpakningerne i den nye formulering er sølvfarvede både foran og bagpå og er mindre sammenlignet med blisterpakningerne i den oprindelige formulering
Oprindelig formulering
Ny formulering
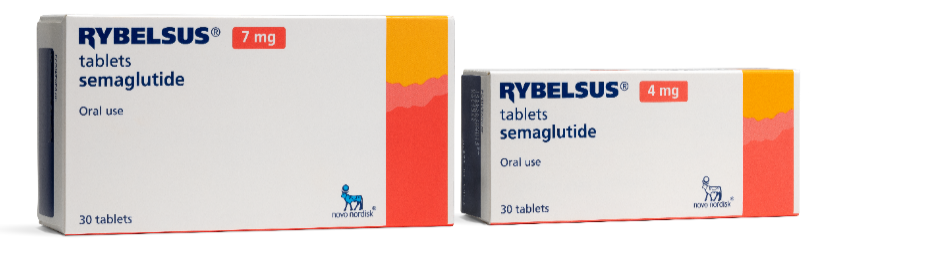
Sekundære pakninger:
Kartoner til de nye formuleringer er mindre
Den oprindelige formulerings karton vs Den nye formulerings karton
Indberetning af utilsigtede hændelser med medicin
Utilsigtede hændelser som f.eks. medicineringsfejl skal rapporteres til Dansk Patientsikkerhedsdatabase: https://stps.dk/da/laering/utilsigtede-haendelser/
Indberetning af formodede bivirkninger:
Læger og andre sundhedspersoner anmodes om at indberette alle formodede bivirkninger hos patienter, der behandles med eller er behandlet med semaglutid, til Lægemiddelstyrelsen via en e-blanket på styrelsens hjemmeside www.meldenbivirkning.dk.
Praktiserende læger anmodes om at indberette formodede bivirkninger via en bivirkningswebservice, der er implementeret i deres lægepraksissystem.
Hvis du har spørgsmål til indberetning af formodede bivirkninger, kan du kontakte Lægemiddelstyrelsen via:
Lægemiddelstyrelsen Axel Heides Gade 1 DK-2300 København S E-mail: Send en mail
Telefon: +45 44 88 95 95
Virksomhedens kontaktoplysninger
Novo Nordisk Denmark A/S
Yderligere information kan fås ved henvendelse til Novo Nordisk Danmark kundeservice på tlf.:8020 0240 eller e-mail: Send en mail.