Fra december 2022 skal alle sponsorer for kliniske forsøg med lægemidler registreres i den europæiske database EudraVigilance for fremover at kunne indberette alvorlige uventede bivirkninger (SUSARs)
I forbindelse med overgangen til den nye EU-forordning for kliniske forsøg med lægemidler vil det ved udgangen af 2022 ikke længere være muligt at indberette alvorlige uventede bivirkninger (suspected unexpected serious adverse reactions - SUSARs) vha. Lægemiddelstyrelsens (LMST) SUSAR e-blanket.
I stedet skal SUSARs fremover indberettes direkte til den europæiske EudraVigilance-database.
Denne ændring gælder for alle igangværende og nye kliniske forsøg, og dermed ikke kun for kliniske forsøg der er ansøgt under den nye forordning. Derfor skal alle sponsorer for kliniske forsøg med lægemidler i Danmark sikrer sig, at de har adgang til EudraVigilance databasen.
Den eksisterende SUSAR e-blanket udløber ved udgangen af 2022. Det er et lovkrav, at sponsor har mulighed for at indberette alvorlige uventede bivirkninger jf. EU-forordning om kliniske forsøg med humanmedicinske lægemidler (nr. 536/2014 af 16. april 2014) artikel 42 og bekendtgørelse om kliniske forsøg med lægemidler på mennesker (BEK nr 295 af 26/04/2004) §8. Derfor skal alle sponsorer sikrer sig, at de er korrekt registreret i EudraVigilance-databasen, og har mulighed for at indberette SUSARs inden d. 01. december 2022.
Nedenfor findes en kort beskrivelse af registrering i EudraVigilance systemet og den påkrævede organisering, samt links til relevant vejledning på EMAs hjemmeside.
Lægemiddelstyrelsen kan ikke yde teknisk support, da systemet driftes af det Europæiske Lægemiddelagentur (EMA).
Vi har tidligere udsendt en lignende nyhed omkring denne overgang d. 20. maj 2022.
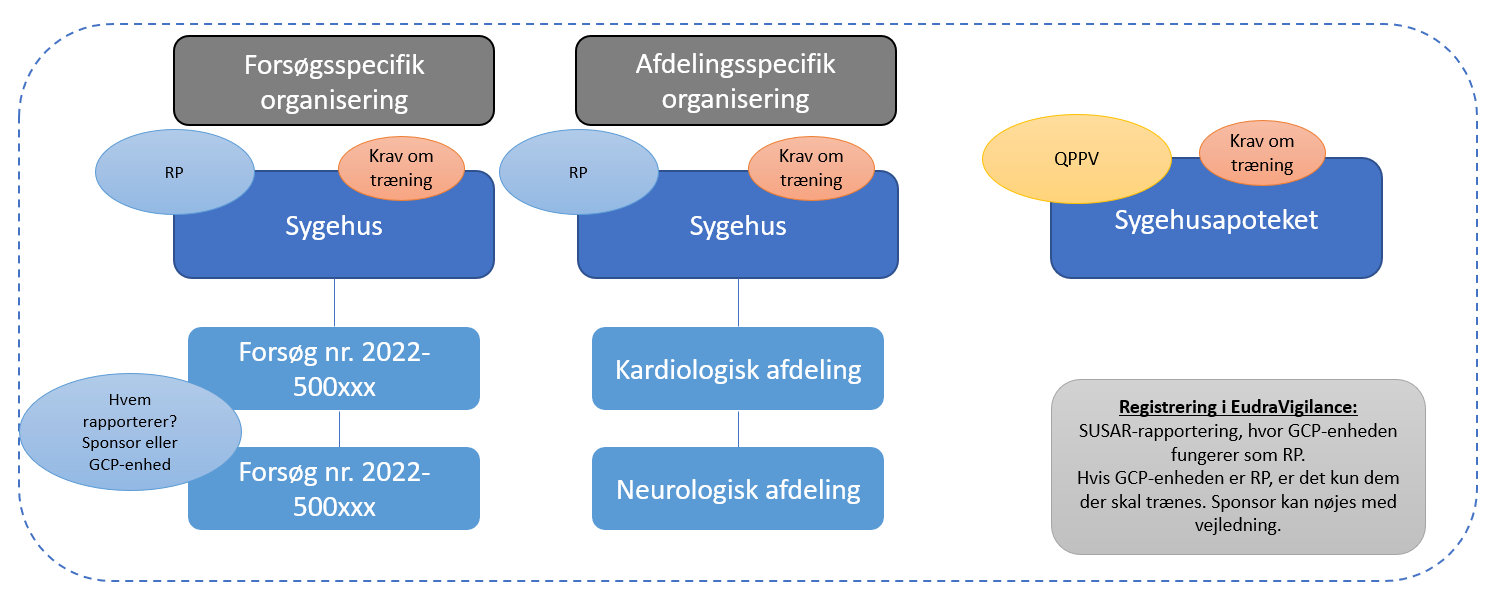
Registrering og organisering af sponsor og sponsororganisation i EudraVigilance
For at kunne indberette SUSARs skal sponsor have en EMA-brugerkonto, hvilket er den samme brugerkonto som skal benyttes til henholdsvis EudraCT-databasen (direktiv forsøg) og CTIS-databasen (forordningsforsøg).
Herefter skal de søge om brugeradgang i EudraVigilance. Forsøget (forsøgsspecifik organisering) eller afdelingen (afdelingsspecifik organisering) skal inden da være oprettet af sponsororganisationen Responsible Person. Det er sponsororganisationens Responsible Person (RP), der kan oprette forsøg eller afdeling samt tildele brugeradgang til de enkelte sponsorer. Denne organisering sikrer, at de enkelte ansatte på sygehusene ikke får adgang til alle bivirkningsindberetninger for alle forsøg, der foregår på sygehuset, men kun til de relevante patientfølsomme data.
Den enkelte forsøgssponsor bør kontakte Sygehusets ledelse hvis det er uklart, hvem der er RP for organisationen i EudraVigilance. Nedenfor ses de to forskellige muligheder for organisering i EudraVigilance (forsøgs- eller afdelingsspecifik organisering).
Tilgængelige vejledninger og support på EudraVigilance
Lægemiddelstyrelsen har ikke adgang til eller mulighed for at registrere sponsorer i databasen, og kan derfor heller ikke yde support for databasen. Det er kun organisationens Responsible Person der kan give brugeradgang. For skift af RP i en organisation henviser vi til EMA’s vejledning i skift af QPPV/RP, der også beskriver support gennem EV Registration ServiceDesk.
Vi henviser til Lægemiddelstyrelsens hjemmeside vedrørende EudraVigilance registrering samt EMAs hjemmeside omkring sikkerhedsrapportering i kliniske forsøg, hvor man kan finde videre links, der beskriver lovkrav og vejledninger.
Notifikationer og ændringer af protokoller i forbindelse med skifte til EudraVigilance skal ikke indsendes til Lægemiddelstyrelsen som substantielle ændringer
Det vurderes ikke at være en substantiel ændring at opdatere ordlyden i eksisterende protokoller fra brugen af Lægemiddelstyrelsens SUSAR e-blanket til direkte rapportering af SUSARs i EudraVigilance. Sådanne ændringer skal derfor ikke indsendes som substantielt amendment til Lægemiddelstyrelsen. De skal heller ikke indsendes til notifikation, med mindre EudraCT-skemaet opdateres med fx en ny ansvarlig for SUSAR-rapportering.