TRISENOX (arsentrioxid): Risiko for medicineringsfejl ved introduktion af 2 mg/ml koncentration
Kære læger og sundhedspersonale
Efter aftale med Det Europæiske Lægemiddelagentur (EMA) og Lægemiddelstyrelsen ønsker Teva (indehaver af markedsføringstilladelsen for TRISENOX) med Teva Denmark A/S som lokal repræsentant, at informere om følgende:
Resumé
-
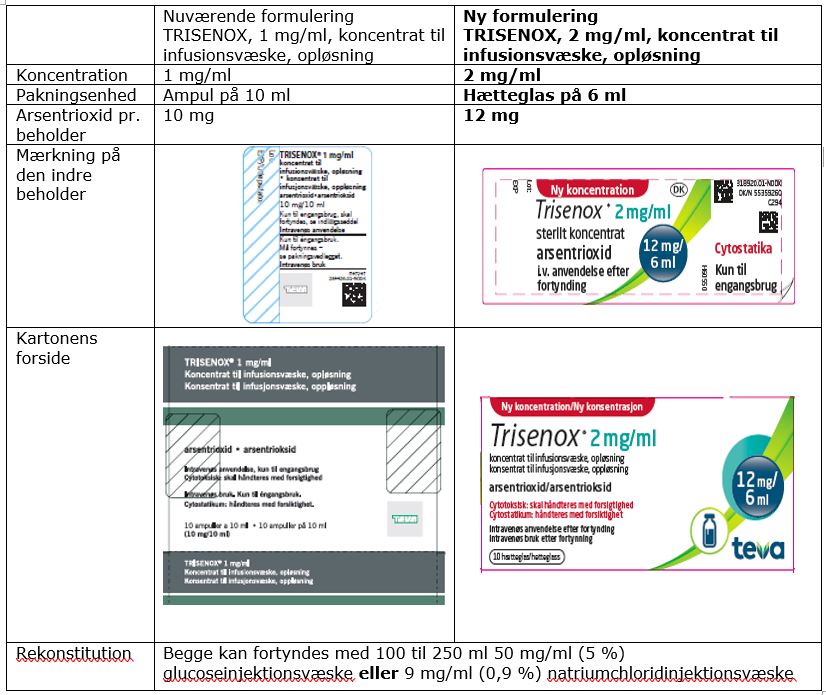
Der er risiko for medicineringsfejl, da TRISENOX (arsentrioxid) bliver erstattet af en ny formulering, der indeholder dobbelt koncentration.
-
1 mg/ml i 10 ml ampul til engangsbrug (indeholdende 10 mg arsentrioxid)
erstattes af -
2 mg/ml i 6 ml hætteglas til engangsbrug (indeholdende 12 mg arsentrioxid)
-
De to forskellige koncentrationer vil midlertidigt være på markedet samtidig, hvilket kan medføre forveksling af de to produkter og dermed medicineringsfejl i form af enten “overdosering” med potentielt fatalt udfald eller “underdosering” med potentielt manglende effekt (se baggrundsafsnittet nedenfor).
-
Kontrollér altid nøje, når fortyndings- og infusionsvolumen af TRISENOX beregnes for at sikre, at patienten får den korrekte dosis af arsentrioxid. Som hjælp til at skelne mellem de to formuleringer har pakningerne særlige kendetegn, som vist i tabellen nedenfor.
Baggrund for denne sikkerhedsinformation
TRISENOX (arsentrioxid) er indiceret til induktion af remission og konsolidering hos voksne patienter med:
- Nydiagnosticeret lav til intermediær risiko akut promyelocyt-leukæmi (APL) (antal hvide blodlegemer, ≤ 10 mia/L) i kombination med all-trans-retinoinsyre (ATRA)
- Recidiverende/refraktær akut promyelocyt-leukæmi (APL) (den tidligere behandling skal have omfattet et retinoid samt kemoterapi)
begge kendetegnet ved tilstedeværelse af t(15;17) translokationen og/eller tilstedeværelse af genet promyelocyt-leukæmi/retinoinsyrereceptor-alfa (PML/RAR-alfa).
Konsekvenserne af medicineringsfejl på grund af ændret koncentration af det markedsførte produkt og forveksling af de to formuleringer er:
Risiko for overdosering: forøgelse af én kendt risiko eller alle kendte risici ved brug af TRISENOX, hvilket kan medføre et potentielt fatalt udfald, som kan skyldes følgende hændelser:
- Massiv blødning på grund af trombocytopeni
- Alvorlige infektioner, sepsis og septisk shock på grund af alvorlig leukopeni
- Hjertestop på grund af QTc-forlængelse
- Akut promyelocyt-leukæmi (APL)-differentieringssyndrom
- Hjerneblødning eller iskæmisk myokardieinfarkt på grund af hyperleukocytose
- Potentiel akut nyreskade eller nyresvigt på grund af øget nefrotoksicitet
- Potentielt leversvigt på grund af øgede stigninger i levertransaminaser, bilirubin og gammaglutamyltransferase.
Se produktresuméets pkt. 4.9 "Overdosering", som beskriver hvordan overdosering håndteres.
Risiko for underdosering: suboptimalt respons på behandling, hvilket medfører risiko for resistens over for kemoterapi med reduceret klinisk respons til følge.
Indberetning af bivirkninger
Læger og sundhedspersonale anmodes om forsat at indberette formodede bivirkninger, i forbindelse med brugen af TRISENOX til Lægemiddelstyrelsen:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Indberetning af utilsigtede hændelser med medicin
Utilsigtede hændelser skal rapporteres til Dansk Patientsikkerhedsdatabase (klik her)
Virksomhedens kontaktoplysninger
Hvis du har spørgsmål eller behov for yderligere oplysninger om TRISENOX koncentrat til infusionsvæske, opløsning, kan du kontakte:
Teva Denmark A/S
Telefon: +45 4498 5511
Med venlig hilsen
Nadeem Mohammed
Country Medical Manager
Teva Denmark A/S