Årsrapport for 2011 - aktiviteter på området medicinsk udstyr
Indledning
I det følgende beskrives Lægemiddelstyrelsens arbejde inden for medicinsk udstyr i 2011. Der fokuseres på nøgletal for området samt dominerende aktiviteter. Generelle oplysninger om Lægemiddelstyrelsens arbejde med medicinsk udstyr er beskrevet på Lægemiddelstyrelsens hjemmeside om medicinsk udstyr.
- Resume
- Året 2011 i Sektion for Medicinsk Udstyr
- Markedsovervågning
- Kliniske afprøvninger
- Eksportcertifikater
- EU-arbejde
- Fabrikantregistreringer
- EUDAMED
- Bemyndigede organer
- Hjemmesiden
- Handlingsplan
- Undervisning og information
- Vil du vide mere?
Resume
Kort oversigt over aktiviteter i 2011:
- 4164 nye sager, hvilket er en stigning på ca 64 % i forhold til 2010. Deraf omhandlede 1515 alvorlige hændelser, hvilket er en stigning på ca. 10 % i forhold til 2010
- 2032 eksportcertifikater blev udstedt på baggrund af 315 ansøgninger. Dette er et fald på ca. 12 % i forhold til 2011
- 21 ansøgninger om klinisk afprøvning blev behandlet, hvilket er et lille fald i forhold til 2010 og 2009. Derudover er der modtaget 27 ændringsansøgninger i 2011
- aktiv deltagelse i 12 EU-arbejdsgrupper
- registrering af 33 nye fabrikanter og repræsentanter. Dette er et markant fald i forhold til 2010, men på niveau med 2009.
Året 2011 i Sektion for Medicinsk Udstyr
I slutningen af 2010 overgik Lægemiddelstyrelsen til digitale arbejdsgange, hvilket bl.a. medførte afskaffelse af papirsager. Dette har medført en stor ændring af vores hverdag med forenklet sagshåndtering, da alt nu foregår digitalt.
Året har været påvirket af forberedelserne til Danmarks overtagelse af formandskabet for EU ved årsskiftet. I den forbindelse skal Lægemiddelstyrelsen bl.a. stå for afholdelsen af to møder, Competent Authorities Medical Devices (CAMD) og Central Management Committee (CMC) på området medicinsk udstyr.
I 2011 blev den Europæiske database for medicinsk udstyr (EUDAMED) for alvor taget i brug, hvilket har medført at medlemslandene nu er pålagt at registrere bl.a. fabrikanter, produkter, og kliniske afprøvninger.
2011 har været præget af den fortsatte stigning i antallet af sager.
På figur 1 ses en oversigt over antallet af sager der er modtaget de sidste 12 år. Som tidligere ses der fortsat en stigning. En del af stigningen i 2011 set i forhold til tidligere år skyldes dog Lægemiddelstyrelsens overgang til nyt journaliseringssystem, hvor man i 2011 i højere grad opdeler sager, da Lægemiddelstyrelsen er overgået til enkeltsags princippet, bl.a. af hensyn til de digitale arbejdsgange.
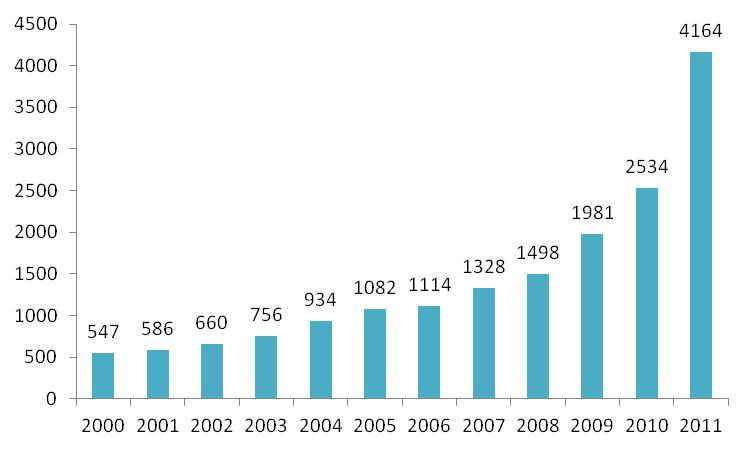
Figur 1: Oversigt over det totale antal sager Lægemiddelstyrelsen har modtaget mellem 2000 og 2011, som vedrører medicinsk udstyr.
Markedsovervågning
Hændelser med medicinsk udstyr
På figur 2 herunder ses en oversigt over antallet af sager, der vedrører hændelser med medicinsk udstyr de sidste 12 år. Der ses en generel stigende tendens, der også er fortsat i 2011, hvor der er modtaget ca. 10 % flere sager, der vedrører hændelser. Det vurderes, at der fortsat er behov for at holde fokus på at få indrapporteret alle hændelser med medicinsk udstyr.
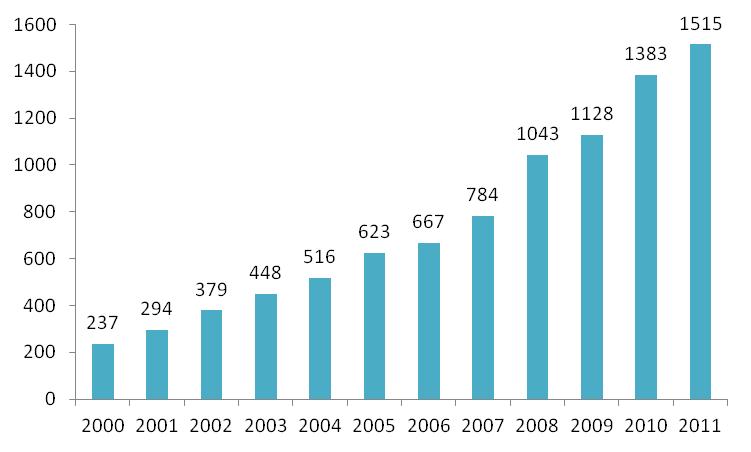
Figur 2: Oversigt over antallet af indberettede sager, der vedrører hændelser i perioden 2000-2011.
På figur 3 ses de indberettede hændelsessager fra 2011 fordelt på udstyrskategorier, angivet i procent. Disse tal udviser ofte variation fra år til år. Baggrunden for variationen er oftest vanskelig at fastlægge. Når der sammenlignes med tallene fra 2010 ses, at det overordnede billede stort set er det samme. I forhold til 2010 ses dog et betydeligt fald i antallet af indberetninger med in vitro-diagnostisk medicinsk udstyr, og en stigning i indberetninger der vedrører aktivt, implantabelt medicinsk udstyr. Ved en sammenligning af disse tal fra 2011 med tilsvarende tal for årene 2008 og 2009 ses dog, at tallene for 2011 er på linie med tidligere år.
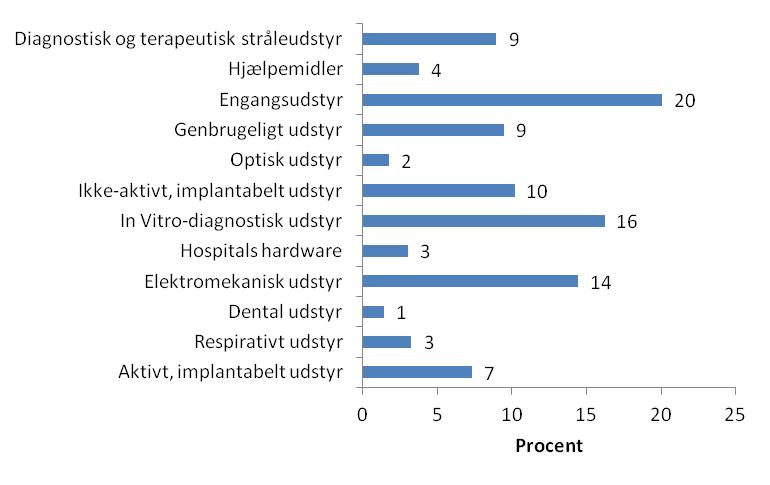
Figur 3: Oversigt over fordeling af hændelser på udstyrskategorier (DS/EN ISO 15525:2000).
For sager, der omhandler medicinsk udstyr til in vitro-diagnostik ses herunder figur 4, der opdeler sagerne på udstyrets klassificering. Der ses ikke væsentlige forskelle til de tilsvarende tal for 2010. Der er dog indført en ny kategori for sager, hvor den nærmere klassificering af udstyr er ukendt på det tidspunkt, hvor data er indsamlet: Disse var tidligere inkluderet i ”Generel IVD”.
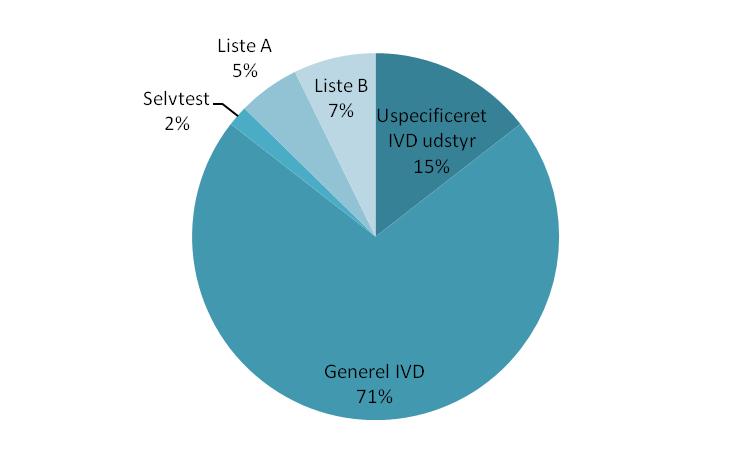
Figur 4: Oversigt over hændelser med in vitro-diagnostisk medicinsk udstyr fordelt på klassificering.
Sikkerhedsrelaterede korrigerende handlinger
Ud af de 1515 indberettede hændelsessager i 2011 vedrørte de 957 sikkerhedsrelaterede korrigerende handlinger, hvilket svarer til 63 %. I 2010 var det tilsvarende tal ca. 50 %.
Hvem indberetter?
På figur 5 herunder ses hændelsessagerne for 2011 fordelt på primær indberetter. Vores nye journaliseringssystem har givet os mulighed for at foretage en opdeling på flere kategorier end tidligere. Det overordnede billede er dog ikke væsentligt forandret i forhold til tidligere.
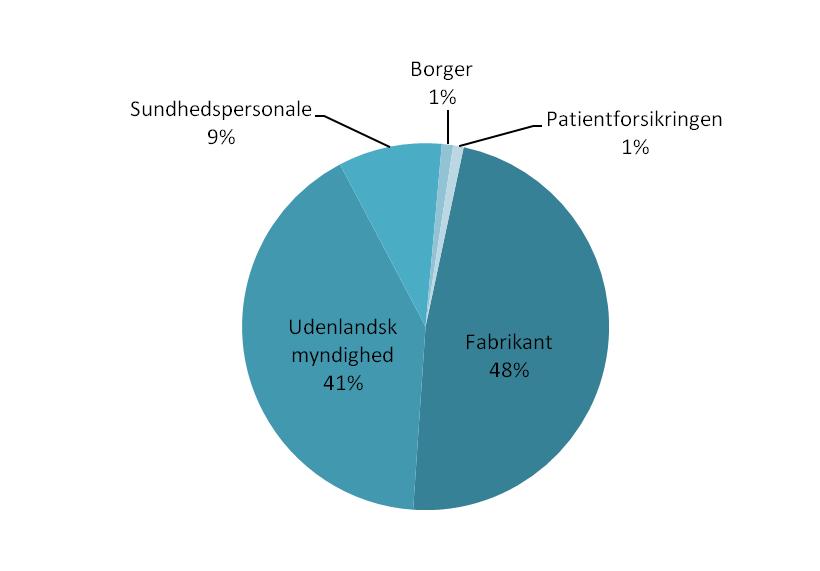
Figur 5: Fordeling af hændelsessager på primær indberetter.
Inspektion af danske fabrikanter
I 2011 inspicerede Lægemiddelstyrelsen danske fabrikanter af medicinsk udstyr. Der blev inspiceret 10 dentallaboratorier og 7 klasse I fabrikanter af hjælpemidler.
Som en integreret del af Lægemiddelstyrelsens arbejde følges der op på de fundne afvigelser, der generelt omhandler dokumentation i relation til af risikoanalyse, markedsovervågning og klinisk evaluering.
Dansk patientsikkerhedsdatabase (DPSD)
Dansk patientsikkerhedsdatabase overgik i 2011 fra Sundhedsstyrelsen til Patientombuddet, hvilket har medført flere ændringer. Der er nu mulighed for at indberette flere informationer, som hjælper os i vores arbejde med at følge op på hændelser, hvor medicinsk udstyr har været involveret.
Flytningen har bevirket en forsinkelse i adgang til de data, hvor medicinsk udstyr menes at have været medvirkende årsag. Vi har derfor ikke i forbindelse med denne rapport mulighed for at oplyse sagsdata på linie med tidligere år.
Markedsovervågningsprojekt vedr. phtalater i medicinsk udstyr
I 2010 trådte der nye regler i kraft for medicinsk udstyr, herunder nye regler vedr. mærkning af visse typer af medicinsk udstyr, der indeholder specifikke phtalater. Derfor gennemførte Lægemiddelstyrelsen i 2011 et markedsovervågningsprojekt, med formålet at undersøge implementeringen af de nye mærkningskrav for udvalgte produkter.
Kliniske afprøvninger
Tilladelser til klinisk afprøvning
I 2011 har Lægemiddelstyrelsen modtaget 21 ansøgninger om klinisk afprøvning af medicinsk udstyr. 10 er modtaget fra danske ansøgere, 11 er fra udenlandske ansøgere.
På figur 6 herunder ses antallet af kliniske afprøvninger fordelt på år, siden Lægemiddelstyrelsen overtog denne opgave i 2006.
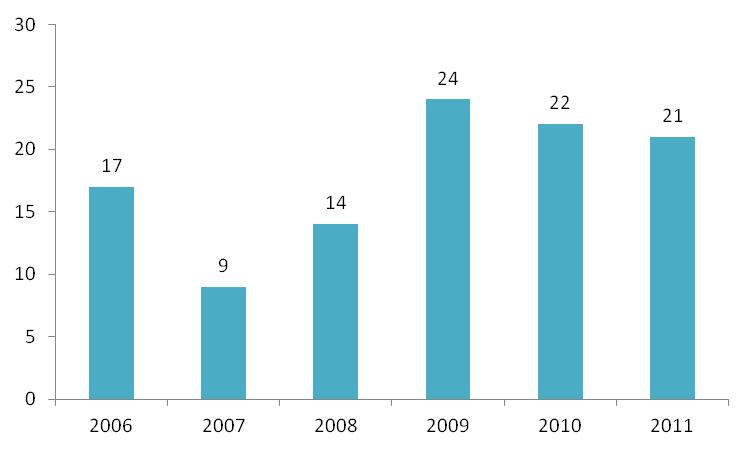
Figur 6: Antal kliniske afprøvninger behandlet per år fra 2006-2011.
På figur 7 ses afprøvningerne fra 2011, fordelt på udstyrsklasser.
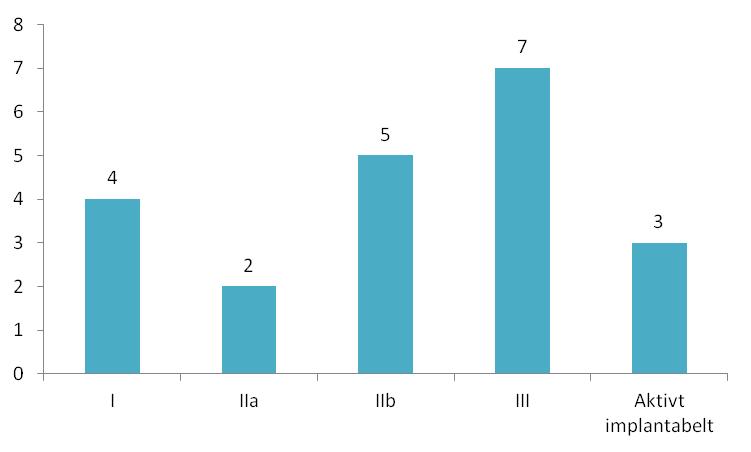
Figur 7: Fordeling af ansøgninger om klinisk afprøvning i 2011 fordelt på risiko- og udstyrsklasser.
Alle ansøgninger modtaget i 2011 med sagsbehandlingsfrist i 2011 er færdigbehandlet rettidigt (inden 60 dage) med følgende resultat ved årsskiftet:
- 2 tilladelser
- 7 tilladelser med vilkår (dvs. krav som skal implementeres inden afprøvningen må iværksættes)
- 4 tilladelse med vilkår til godkendelse (dvs. at dokumentation for implementering af vilkår skal godkendes, inden afprøvningen må iværksættes)
- 2 ansøgninger henlagt, ingen afgørelse (ansøgning ukomplet eller afprøvning aflyst)
- 6 afprøvninger modtaget i 2011 har sagsbehandlingsfrist i 2012.
Derudover modtog vi i 2011 27 ændringsansøgninger til kliniske afprøvninger. Dette tal er ikke opgjort tidligere.
Inspektion af kliniske afprøvninger
Som led i Lægemiddelstyrelsens overvågning af kliniske forsøg med medicinsk udstyr, blev der i 2011 foretaget inspektion af tre kliniske afprøvninger. Inspektionerne blev foretaget ved besøg hos den forsøgsansvarlige, der i alle tilfælde var danske firmaer, og i et tilfælde endvidere ved besøg hos den forsøgsansvarlige investigator.
Eksportcertifikater
Lægemiddelstyrelsen udsteder eksportcertifikater (Free Sales Certificates) til danske fabrikanter af medicinsk udstyr. I 2011 blev der udstedt 2032 certifikater, på baggrund af 315 ansøgninger. Dette er ca. 12 % færre certifikater end i 2010.
Certifikaterne er udstedt til 65 forskellige danske fabrikanter, hvilket er et mindre fald i forhold til 2010.
EU-arbejde
Sektionen for medicinsk udstyr deltager i udvalgte EU arbejdsgrupper på området medicinsk udstyr. Gennem det arbejde har Lægemiddelstyrelsen i 2011 bidraget til udgivelsen af vejledningen "Manual on borderline and classification in the Community Regulatory framework for medical devices" samt EU-Kommissionens hjemmeside om klinisk afprøvning og evaluering.
Europæiske MEDDEV vejledninger skal fremlægges og godkendes af Medical Devices Expert Group (MDEG), før de bliver publiceret og taget i brug. Det sidste MDEG møde, der var planlagt til december 2011 blev imidlertid udskudt, og derfor er udgivelsen af vejledninger mv. for 2011 udskudt til begyndelsen af 2012.
Fabrikantregistreringer
Lægemiddelstyrelsen foretog i 2011 56 afregistreringer, enten pga. virksomhedsophør, ophør af registreringspligtige aktiviteter, eller ændringer i forretningsstruktur, såsom salg af virksomhed mv. Samtidig modtog vi nye registreringer fra 33 fabrikanter og repræsentanter. Antallet af nye registreringer er noget mindre end for 2010, men på niveau med 2009.
I 2011 trådte en ny gebyrbekendtgørelse i kraft, som tilsigter at styrelsens arbejde med medicinsk udstyr fremover vil være fuldt gebyrdækket. Bekendtgørelsen medfører, at årsgebyret for danske fabrikanter og repræsentanter nu afhænger af virksomhedens størrelse, som angivet ved antal ansatte oplyst i det centrale virksomhedsregister.
EUDAMED
1. maj 2011 trådte EUDAMED beslutningen i kraft. Dette betyder, at den europæiske database for medicinsk udstyr (EUDAMED) og medlemsstaterne har siden den dato været forpligtet til at registrere nationale informationer vedrørende:
- fabrikanter og repræsentanter af klasse I, IVD, system- og behandlingspakker, og virksomheder der steriliserer medicinsk udstyr, der er markedsført usterilt
- udstyr af ovenstående typer, der er markedsført efter 1. maj 2011
- sikkerhedsrelaterede korrigerende handlinger
- certifikater fra bemyndigede organer
- kliniske afprøvninger.
Dette har i Danmark betydet, at der nu er krav til danske fabrikanter og repræsentanter af klasse I, IVD og system- og behandlingspakker om at registrere alt nyt udstyr, der markedsføres efter 1. maj 2011 individuelt i Lægemiddelstyrelsen.
Samtidig skal Lægemiddelstyrelsen ikke længere modtage registreringer fra fabrikanter uden for Danmark, når de markedsfører IVD udstyr i Danmark, da disse registreres i EUDAMED af det land, hvor de har hovedsæde.
Som noget nyt har Lægemiddelstyrelsen fra 1. maj 2011 registreret oplysninger om kliniske afprøvninger i EUDAMED.
Oplysningerne består af stamdata og afgørelser og kan anvendes af medlemslandene i EU og EU-Kommissionen i forbindelse med overvågning af kliniske afprøvninger af medicinsk udstyr.
Lægemiddelstyrelsen modtager oversigter over udstedte og ændrede certifikater mv., fra danske bemyndigede organer. Disse oplysninger bliver ligeledes lagt i EUDAMED af Lægemiddelstyrelsen, jf. beslutningen.
Bemyndigede organer
Som en del af Lægemiddelstyrelsens arbejde med at overvåge danske bemyndigede organers aktiviteter i Danmark, blev der i 2011 udført én inspektion af det bemyndigede organs hovedsæde.
På baggrund af inspektionen opretholdes bemyndigelsen.
Hjemmesiden
Lægemiddelstyrelsens hjemmeside www.medicinskudstyr.dk er i 2011 relanceret. Den fremtræder nu i et nyt design. I forbindelse med relanceringen er de erfaringer, Lægemiddelstyrelsen har fået fra den tidligere hjemmeside, blevet anvendt på at sikre en mere brugervenlig tilgang til emner.
Handlingsplan
I 2011 har Lægemiddelstyrelsen i samarbejde med eksterne konsulenter gennemført et projekt, der skulle afdække om anvendelse af LEAN, kunne forbedre og rationalisere interne arbejdsgange. Lægemiddelstyrelsen har som resultat implementeret ændringer, som optimerer udnyttelse af ressourcerne.
Undervisning og information
Vi har bidraget som gæsteundervisere på en række af DS Certificerings, Medicoindustriens og TOPRAs kurser inden for området.
Du kan læse mere om de nye krav vedr. individuel registrering af udstyr, der trådte i kraft 1. maj 2011 på Lægemiddelstyrelsens hjemmeside om medicinsk udstyr.
Vil du vide mere?
Du kan læse mere detaljeret om sektionens forskellige arbejdsopgaver og ansvarsområder på vores hjemmeside www.medicinskudstyr.dk, hvor der bl.a. også kan ses eksempler på typiske sagsbehandlingsforløb.
