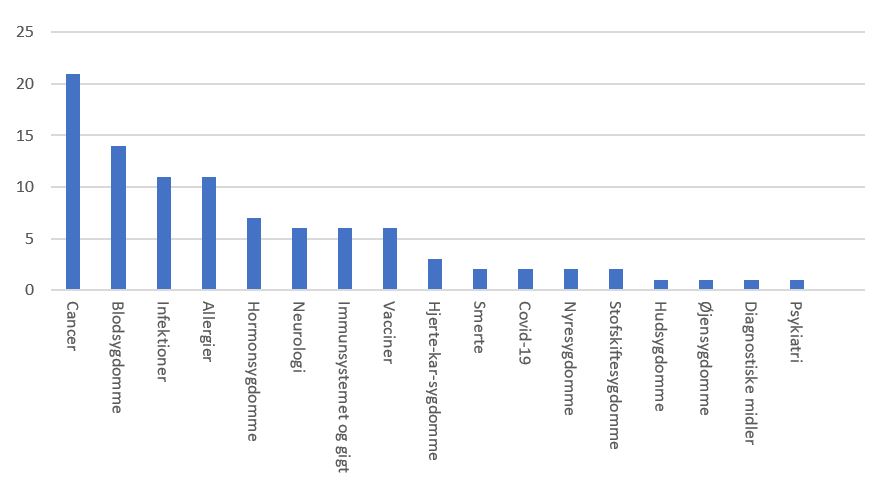
Cancermedicin udgjorde den største andel af godkendt ny medicin i 2020
Selv om fokus de seneste måneder har været på godkendelse af COVID-19-vacciner, udgør de en meget lille del af den medicin, det europæiske medicinalagentur EMA har vurderet – og anbefalet godkendelse af – i 2020. Cancermedicin kom ind på en førsteplads med 22% af de ansøgninger om medicin, EMA i 2020 anbefalede godkendelse af.
I alt gav EMA i 2020 en positiv vurdering af 97 nye lægemidler, mens to blev afvist, og 16 producenter valgte at trække ansøgningen tilbage. Det kan man læse i den årlige oversigt over medicinske highlights 2020, EMA netop har udgivet med et overblik over de forskellige produkter og de sygdomme, de retter sig mod.

19 typer medicin godkendt efter fremskyndet procedure
COVID-19-vaccinerne er blevet godkendt efter en særligt fremskyndet procedure. At fremskynde proceduren er ikke ualmindeligt, når der er stor interesse i at få produkter hurtigt ud i samfundet. Således findes der nogle procedurer, man kan bruge på medicin og vacciner, som dækker behov, man ikke kan imødekomme med den eksisterende medicin. I 2020 fik 19 typer medicin en særlig hurtig godkendelsesproces, og i alle disse var der en relativt stor andel cancermedicin.
Medicin til et bredt spektrum af sygdomme
Årets mest omtalte anbefaling af godkendelse kom kort før årsskiftet og handlede om den første COVID-19-vaccine fra Pfizer/BioNTech, der straks blev taget i brug i det meste af Europa. Men i modsætning til COVID-vaccinerne er der kun begrænset opmærksomhed om alle de øvrige lægemidler, der løbende bliver anbefalet og sat i produktion. De retter sig mod et bredt spektrum af sygdomme og lidelser, som det også er vigtigt at få mulighed for at behandle.
EMA's anbefalede produkter i 2020
Ikke kun nye produkter, men også ny brug eller nye indholdsstoffer
EMA’s anbefalinger om medicin-godkendelser handler ikke kun om ny medicin, men årets anbefalinger betød også, at 83 allerede godkendte medicintyper blev anbefalet godkendt til behandling af andre sygdomme, end de tidligere er godkendt til. Desuden fik 39 nye indholdsstoffer en positiv vurdering med på vejen.
Justering på baggrund af indberetninger
Når medicin er godkendt, har EMA ansvar for i samarbejde med de nationale lægemiddelstyrelser at overvåge indberetninger om evt. bivirkninger. Det kan fx medfølge, at anbefalinger om brug i indlægssedlerne skal justeres, og rapporten rummer en oversigt over de produkter, EMA ændrede anbefalingerne til.