Årsrapport for 2010 - aktiviteter på området medicinsk udstyr
Indledning
I det følgende beskrives Lægemiddelstyrelsens arbejde inden for medicinsk udstyr i 2010. Der er i denne årsrapport blevet fokuseret på nøgletal for området, samt dominerende aktiviteter. Generelle oplysninger om sektionens arbejde, der tidligere har været en del af rapporten, er en integreret del af vores hjemmeside, og du kan finde det her.
Resume
Året 2010 i Sektion for Medicinsk Udstyr
Markedsovervågning
Kliniske afprøvninger
Eksportcertifikater
EU-arbejde
Registreringer
Bemyndigede organer
Undervisning og information
Vil du vide mere?
Resume
Kort oversigt over aktiviteter i 2010:
- 2534 nye sager blev påbegyndt, hvilket er en stigning på 28 % i forhold til 2009.
Deraf omhandlede 1383 sager hændelser, hvilket er en stigning på 23 % i forhold til 2009. - 2266 eksportcertifikater blev udstedt på baggrund af 368 ansøgninger, hvilket er 10 % flere certifikater end i 2009.
- 22 ansøgninger om kliniske afprøvninger blev behandlet, hvilket er på niveau med 2009.
- Aktiv deltagelse i 14 EU arbejdsgrupper.
- Registreret 51 nye danske fabrikanter, hvilket næsten er en fordobling i forhold til 2009.
- Året 2010 i Sektion for Medicinsk Udstyr
Året 2010 var i sektionen for medicinsk udstyr, og Lægemiddelstyrelsen generelt, præget af forberedelserne til at overgå til digitale arbejdsprocesser. Løsningen blev taget i brug d. 8. december 2010. Digitaliseringen betyder at vi nu ikke længere arbejder med fysiske papirsager, alt foregår elektronisk. Derudover var arbejdet i sektionen påvirket af den stadigt stigende mængde af indberetninger.
Herunder ses en oversigt over antallet af sager, der er modtaget de sidste 11 år. Som tidligere ses en fortsat stigende aktivitet på området.
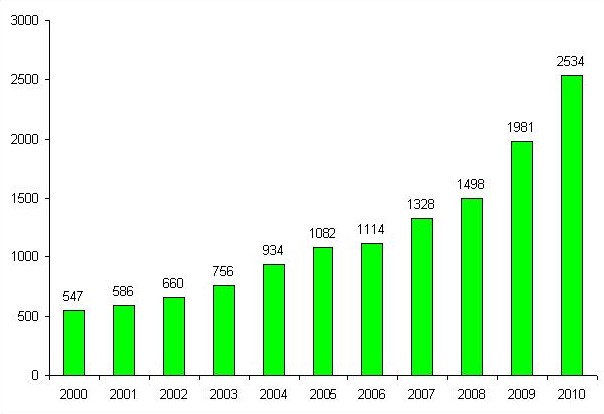
Figur 1: Oversigt over antallet af sager modtaget i perioden 2000 til 2010
Markedsovervågning
Hændelser med medicinsk udstyr
På figur 2 ses en oversigt over antallet af sager, der vedrører hændelser med medicinsk udstyr, de sidste 11 år. Der har været en generelt stigende tendens, der er øget i 2010, hvor der er observeret 23 % flere indberetninger af hændelser.
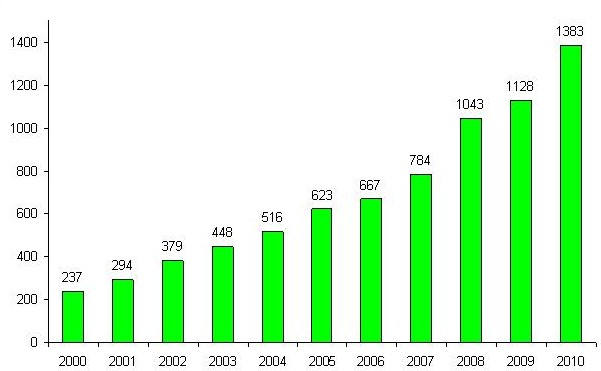
Figur 2: Oversigt over antallet af indberettede sager der vedrører hændelser i perioden 2000-2010
På figuren herunder ses de indberettede sager fra 2010 fordelt på udstyrskategorier. Disse tal er generelt svære at analysere baggrunden for, og der kan være stor variation fra år til år. Når vi sammenligner med tallene fra 2009 ses specielt en stigning i indberettede sager der vedrører medicinsk udstyr til in vitro-diagnostik, og der ses et fald i antallet af sager vedrørende optisk udstyr, som er tilbage på niveau med 2008. Desuden ses en stigning i antallet af sager der vedrører diagnostisk og terapeutisk stråleudstyr og aktivt implantabelt udstyr.
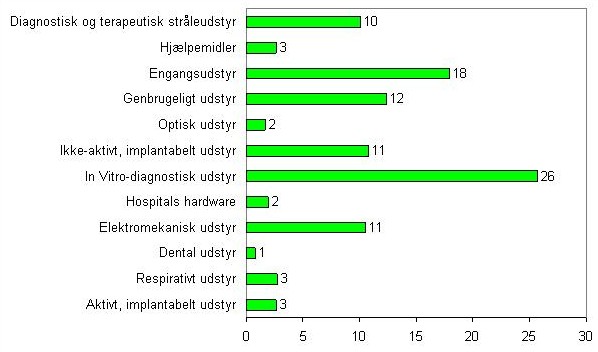
Figur 3: Oversigt over fordeling af hændelser på udstyrskategorier (DS/EN ISO 15225:2000)
For sager der omhandler medicinsk udstyr til in vitro-diagnostik ses herunder en figur der viser en yderligere opdeling efter klassificering. Der ses ikke væsentlige ændringer i forhold til 2009.
Figur 5 Oversigt over hændelser med in vitro-diagnostisk medicinsk udstyr fordelt på type
Sikkerhedsrelaterede korrigerende handlinger (FSCA)
Ud af de 1383 indberettede hændelsessager i 2010, vedrørte de 696 korrigerende handlinger. Dette er en stigning på 9 % i forhold til 2009.
Hvem indberetter?
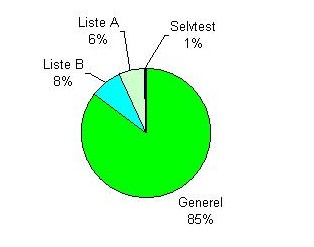
I cirkeldiagrammet herunder ses en oversigt over hændelser fordelt på indberettere.
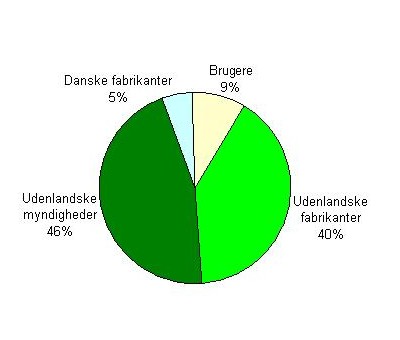
Figur 6: Fordeling af primære indberettere
Det overordnede billede har ikke ændret sig stort i forhold til 2009, dog ses et mindre fald i antallet vi har modtaget fra brugere.
Når størstedelen af alle indberetninger kommer fra udlandet, skyldes det dels, at mange udenlandske fabrikanter markedsfører medicinsk udstyr i Danmark, og dels at flere hændelser sker i udlandet, pga. det større befolkningsgrundlag.
Inspektion af danske fabrikanter
I 2010 inspicerede Lægemiddelstyrelsen 10 fabrikanter af medicinsk udstyr, primært indenfor kategorien hjælpemidler. Der blev observeret større og mindre afvigelser, generelt indenfor dokumentation af risikoanalyse og klinisk evaluering.
Dansk Patient Sikkerhedsdatabase (DPSD)
Lægemiddelstyrelsen har i 2010 gennemgået rapporter om utilsigtede hændelser indsendt til Sundhedsstyrelsen via Dansk Patient Sikkerheds Database (DPSD), med henblik på at identificere hændelser, hvor medicinsk udstyr kan have været direkte eller indirekte årsag.
Lægemiddelstyrelsen fandt i alt 1005 rapporter, hvor udstyr var angivet som medvirkende årsag. Ud af disse har vi vurderet, at 71 rapporter vedrørte medicinsk udstyr og var indberetningspligtige. Disse er blevet behandlet, med henblik på at identificere hændelser, der ikke allerede er blevet indberettet via Lægemiddelstyrelsens indberetningssystem.
Kliniske afprøvninger
Tilladelser til kliniske afprøvninger
I 2010 har Lægemiddelstyrelsen foretaget faglig sagsbehandling af 22 ansøgninger om kliniske afprøvninger. 13 er modtaget fra danske ansøgere, 9 fra udenlandske ansøgere.
På figuren herunder ses antallet af kliniske afprøvninger fordelt på år, siden Lægemiddelstyrelsen overtog denne opgave.
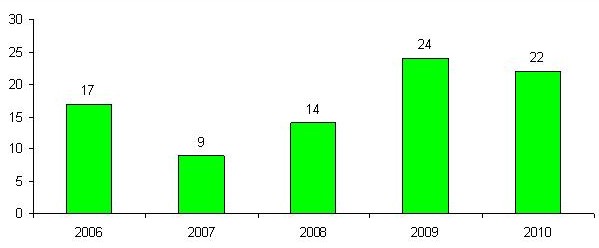
Figur 7: Antal kliniske afprøvninger per år fra 2006-2010
På følgende figur ses de kliniske afprøvninger fra 2010, fordelt på udstyrsklasser.
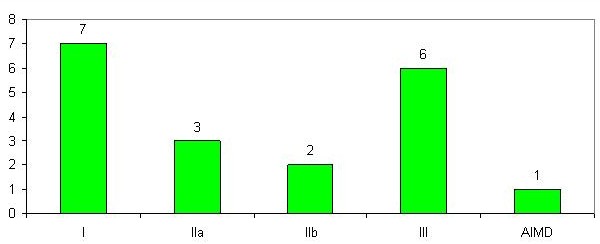
Figur 8: Fordeling af ansøgninger om kliniske afprøvninger i 2010 på risiko- og udstyrsklasser
Alle ansøgninger modtaget i 2010 med sagsbehandlingsfrist i 2010 er færdigbehandlet rettidigt (inden 60 dage) med følgende resultat ved årsskiftet:
- 3 tilladelser
- 10 tilladelser med vilkår (dvs. krav som skal implementeres inden afprøvningen må iværksættes)
- 1 tilladelse med vilkår til godkendelse (dvs. at dokumentation for implementering af vilkår skal godkendes, inden afprøvningen må iværksættes)
- 2 ansøgninger henlagt, ingen afgørelse (ansøgninger ukomplette)
- 1 afventer yderligere dokumentation i 2011
- 6 afprøvninger pågår sagsbehandling
Inspektion af kliniske afprøvninger
I 2010 blev to kliniske afprøvninger inspiceret ved besøg hos den forsøgsansvarlige investigator. I begge tilfælde var forsøgsansvarlige et udenlandsk firma.
Eksportcertifikater
Lægemiddelstyrelsen udsteder eksportcertifikater til danske fabrikanter af medicinsk udstyr. I 2010 blev der udstedt 2266 certifikater, på baggrund af 368 ansøgninger, hvilket er 9 % flere certifikater end i 2009.
Certifikaterne er udstedt til 73 forskellige danske fabrikanter, hvilket er 17 % flere fabrikanter, der har ansøgt om eksportcertifikater i forhold til 2009.
EU arbejde
Sektionen for medicinsk udstyr deltager i en lang række EU arbejdsgrupper på området. Gennem det arbejde bidrog Lægemiddelstyrelsen i 2010 til udgivelsen af følgende dokumenter:
Commission Decision 2010/227/EU - OJ L102/45: Eudamed - European Databank on Medical Devices
Guidance Notes for Manufacturers of Custom-Made Medical Devices
Interpretative document of the Commission's services on placing on the market of medical devices
MEDDEV 2.4/1 rev.9: Classification of MD
MEDDEV 2.7/3: Clinical investigations: serious adverse event reporting
MEDDEV 2.7/4: Guidelines on Clinical investigations: a guide for manufacturers and notified bodies
NBOG BPG 2010-1: Guidance for Notified Bodies auditing suppliers to medical device manufacturers
NBOG BPG 2010-2: Guidance on Audit Report Content
NBOG BPG 2010-3: Certificates issued by Notified Bodies with reference to Council Directives 93/42/EEC, 98/79/EC, and 90/385/EEC
NBOG CL 2010-1: Checklist for audit of Notified Body’s review of Clinical Data/Clinical Evaluation
NBOG F 2010-1: Certificate Notification to the Commission and other Member States
Ovenstående dokumenter kan du finde link til her.
Registreringer
I 2010 registrerede Lægemiddelstyrelsen 51 nye danske fabrikanter. Samtidig blev 47 afregistreret, enten fordi de er ophørt med registreringspligtige aktiviteter, eller pga. forretningsomlægninger.
Det større antal registreringer der er foretaget i 2010 i forhold til 2009, skyldes blandt andet, at Lægemiddelstyrelsen udførte et mindre projekt, hvor ikke-registrerede dental-laboratorier blev opsøgt, med henblik på at den lovpligtige registrering blev foretaget.
Bemyndigede organer
Som en del af Lægemiddelstyrelsens arbejde med at overvåge bemyndigede organers aktiviteter i Danmark, blev der i 2010 udført to inspektioner. Én inspektion i det bemyndigede organs hovedsæde, samt én fulgt inspektion, hvor Lægemiddelstyrelsen observerede det bemyndigede organ auditere en dansk fabrikant af medicinsk udstyr.
På baggrund af de to inspektioner opretholdes bemyndigelsen.
Undervisning og information
I 2010 gennemførte Lægemiddelstyrelsen, i samarbejde med flere brancheorganisationer, en informationskampagne omkring de nye regler der trådte i kraft d. 21. marts 2010. Kampagnen rettede sig primært mod fabrikanter af medicinsk udstyr efter mål og fabrikanter af klasse I udstyr.
Derudover var vi gæsteundervisere på en række af Dansk Standards og Medicoindustriens kurser på området.
Vil du vide mere?
Du kan læse mere detaljeret om sektionens forskellige arbejdsopgaver og ansvarsområder på vores hjemmeside, hvor der bl.a. også kan læses eksempler på typiske sagsbehandlingsforløb.
