Årsrapport 2017 for indberetning om bivirkninger
Indberetninger om bivirkninger 2017
Lægemiddelstyrelsen overvåger sikkerheden ved al medicin i Danmark. Alle kan indberette bivirkninger til Lægemiddelstyrelsen – og en formodning er nok. Til forskel fra andre sundhedspersoner, patienter og pårørende har læger, tandlæger og jordemødre en pligt til at indberette formodede bivirkninger til Lægemiddelstyrelsen. Lægemiddelstyrelsen overvåger dagligt de indberetninger om bivirkninger, der sendes til Lægemiddelstyrelsen. Sammen med fx resultater af kliniske studier og registerstudier er indberetninger om formodede bivirkninger vigtige for at opdage nye mulige bivirkningssignaler ved medicin.
Læger, tandlæger og jordemødre skal indberette alle formodede alvorlige bivirkninger og alle formodede uventede bivirkninger, der ikke fremgår af medicinens produktinformation, bortset fra formodede bivirkninger som følge af medicineringsfejl.
Alvorlige bivirkninger skal indberettes til Lægemiddelstyrelsen inden 15 dage. Derudover skal de indberette alle formodede bivirkninger til ny medicin, de første to år efter den er kommet markedet. Det gælder dog ikke for generiske lægemidler, hvor indberetningspligten omfatter alle formodede alvorlige bivirkninger og alle formodede uventede bivirkninger, bortset fra formodede bivirkninger som følge af medicineringsfejl, efter lægemidlerne er kommet på markedet.
Lægemiddelstyrelsen kan derudover beslutte, at et lægemiddel skal være omfattet af skærpet indberetningspligt (pligt til at indberette alle formodede bivirkninger bortset fra bivirkninger som følge af medicineringsfejl) i en periode. En ajourført fortegnelse over godkendte lægemidler, hvor læger, tandlæger og jordemødre skal indberette alle formodede bivirkninger, er offentliggjort på Lægemiddelstyrelsens hjemmeside.
Antal indberetninger om formodede bivirkninger i 2017
| Andel alvorlige | Andel ikke-alvorlige | Samlet antal indberetninger |
| 2377 | 4615 | 6992 |
Kilder til indberetninger 2017
| Læger | Øvrige sundhedsprofessionelle | Patienter og pårørende |
| 44% | 18% | 38% |
| 3076 | 1259 | 2657 |
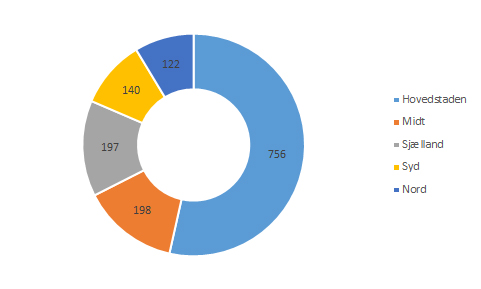
Indberetninger fra de fem regioner
Ud af de i alt 3076 indberetninger, som Lægemiddelstyrelsen modtog fra læger 2017, kommer de 1413 af dem fra regionerne.
Direkte indberetninger fra regioner, inkl. dubletter i 2017
Tendensen fra de seneste år gjorde sig også gældende i 2017 – de regioner, som har en bivirkningsmanagerfunktion, indberetter langt mere end de regioner, der ikke har etableret denne funktion set i forhold til regionens størrelse, og hvad de indberettede før og efter implementeringen. En bivirkningsmanager gør det væsentligt lettere og hurtigere for hospitalslæger at indberette formodede bivirkninger. Lægen skal kun oplyse patientens navn og CPR-nummer, den medicin, der formodes at have forårsaget bivirkninger, dosis og bivirkning samt hospital og afdeling, og så indberetter bivirkningsmanageren den formodede bivirkning til Lægemiddelstyrelsen.
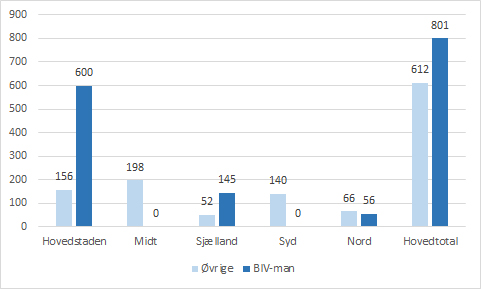
Over halvdelen af de bivirkningsindberetninger, som Lægemiddelstyrelsen modtager på landsplan fra regionerne, indberettes af en bivirkningsmanager. Dykker man yderligere ned i tallene på regionsniveau, vil man finde endnu større forskelle i de regioner, hvor bivirkningsmanagerfunktionen har været etableret gennem flere år. Region Hovedstaden har siden 2013 haft en bivirkningsmanagerfunktion som en integreret del i deres klinisk farmakologiske afdeling, og i 2017 modtog Lægemiddelstyrelsen 600 indberetninger ud af 756 indberetninger fra Region Hovedstaden via en bivirkningsmanager svarende til 79%. Fra Region Sjælland, som har haft ordningen siden 2014, modtog Lægemiddelstyrelsen i 2017 74% af regionens indberetninger fra en bivirkningsmanager. Region Nord etablerede en bivirkningsmanagerfunktion i midten af 2017, og efter knapt et halvt år med funktionen kommer 44% af regionens indberetninger fra deres bivirkningsmanager. Sammenlignet med indberetningstallet fra Region Nord i 2016 (total 66) har etableringen resulteret i næsten en fordobling på bare et halvt år (total 122 i 2017).
Direkte indberetninger fra regionernes bivirkningsmanagerfunktioner i 2017. I region Midt og Syd er der ikke etableret bivirkningsmanagerfunktioner i 2017.
Lægemiddelstyrelsen er rigtig glad for samarbejdet med bivirkningsmanagerne, og vi kan tydeligt se en øget kvalitet i indberetningerne fra netop disse funktioner. Bivirkningsmanagerne bliver hurtigere rutineret i korrekt udfyldelse og indsendelse af nødvendige data om en bivirkningssag. Det giver langt færre opfølgninger, og det er både til glæde og gavn for patientsikkerheden, regionerne og Lægemiddelstyrelsen, da det frigiver tid til andre opgaver.
Lægemiddelstyrelsen glæder sig over, at Region Midt i 2018 kører et pilotforsøg med bivirkningsmanagerfunktionen. Det er Aarhus Universitetshospital (AUH), som per 1.juni 2018 og 6 måneder frem, har etableret denne funktion på deres klinisk farmakologiske afdeling.
Set fra et overordnet perspektiv ser Lægemiddelstyrelsen gerne, at antallet af indberetninger fra hospitalerne øges. Det er netop her rigtig meget ny medicin anvendes og derfor også her, at vi kan få væsentlig ny information omkring lægemiddelsikkerheden.
Indberetninger fra patienter og pårørende
Ligesom i de foregående år udgør indberetninger om formodede bivirkninger fra patienter og pårørende en stor del af de bivirkningsindberetninger, som Lægemiddelstyrelsen modtager. Niveauet i 2017 er det samme som i 2016 nemlig 38%. En del af sagerne kommer fra Patienterstatningen, som skal sende kopi af afgørelser om erstatning for lægemiddelskader til Lægemiddelstyrelsen og underrette Lægemiddelstyrelsen om alle anmeldelser om lægemiddelskader af alvorlig eller principiel karakter (bekendtgørelse nr. 489 af 3. maj 2018 om administration af sager om lægemiddelskadeerstatninger), så oplysninger om bivirkninger kan indgå i overvågningen lægemiddelsikkerheden.
Lægemiddelstyrelsen modtog i 2017 i alt 978 sager fra Patienterstatningen. Patienterstatningen har i de seneste år – og igen i 2017 – modtaget mange anmeldelser om granulomer (knuder i underhuden) hos børn efter vaccination, som viser sig i indberetningsstatistikken.
Danske bivirkningssignaler sendt til EU-netværket i 2017
Lægemiddelstyrelsen overvåger hver dag bivirkningsindberetningerne for at kunne opdage eventuelle nye bivirkningssignaler og andre problemstillinger vedrørende bivirkninger og uhensigtsmæssig brug.
Et bivirkningssignal er en ny mulig årsagssammenhæng mellem en bivirkning og en bestemt type medicin eller et nyt aspekt af en allerede kendt sammenhæng. Bivirkningssignaler kan komme fra både bivirkningsindberetninger og mange andre kilder som fx overvågningsprogrammer, den videnskabelige litteratur, forskellige typer studier, lægemiddelmyndigheder i andre lande, medierne eller henvendelser fra borgere og sundhedspersoner.
Signaler om nye (ikke allerede kendte) typer af bivirkninger eller ændringer i form af, at kendte bivirkninger forekommer hyppigere end forventet eller er mere alvorlige end først antaget bliver sendt videre i EU-netværket til den europæiske bivirkningskomité PRAC eller det land i EU, der overordnet er ansvarlig for godkendelse og overvågning af den pågældende medicin. Tabellen beskriver de danske bivirkningssignaler, som Lægemiddelstyrelsen arbejdede med og sendte videre i EU-netværket i 2017.
Danske bivirkningssignaler, som Lægemiddelstyrelsen sendte videre i EU-netværket i 2017
| Medicin | Signal | Kilde | Status |
| Intravenøse væsker | Saltmangel (Hyponatriæmi) - ny evidens | Bivirkningsindberetninger | Signal afsluttet |
| Hydrochlorthiazid til behandling til behandling af forhøjet blodtryk | Hudkræft | Litteraturstudie | Signal afsluttet |
| P-piller | Brystkræft | Litteraturstudie | Signal afsluttet |
| P-piller | Selvmord | Litteraturstudie | Signal afsluttet |
Udbredelse af viden om lægemiddelsikkerhed
Lægemiddelstyrelsen arbejder hele tiden på at skærpe opmærksomheden og kendskabet til at indberette bivirkninger og til sikkerhedsproblemstillinger ved bestemte typer medicin. Blandt andet underviser Lægemiddelstyrelsen i lægemiddelsikkerhed på lægernes hoveduddannelse, holder oplæg på konferencer og lignende, besvarer henvendelser fra sundhedspersoner og borgere, der har spørgsmål til medicin og kører kampagner via blandt andet sociale medier.
| Lægebreve sendt til læger med sikkerhedsinformation om medicin: | 30 |
| Telefoniske henvendelser samt e-mail-henvendelser om bivirkninger og anmeldelser om bivirkninger via hovedpostkasse og hovednummer: | 1000 |
| Undervisning i lægemiddelsikkerhed: | 23 |
| Præsentationer på konferencer og lignende: | 5 |
| Kampagner om at melde bivirkninger: | 2 |
Nationale samarbejder er vigtige
Samarbejde på tværs af det danske sundhedsvæsen er afgørende for patientsikkerheden, når det gælder overvågning af medicin. Derfor har Lægemiddelstyrelsen på overvågningsområdet etableret fora og råd, der sikrer den nødvendige dialog og input på tværs af faggrænser og patientforeninger.
Lægemiddelstyrelsen afholder regelmæssige møder omkring bivirkninger og andre risici ved medicin med følgende råd og fora:
- Rådet for Lægemiddelovervågning (fire gange årligt)
- Kvalitetsforum (to gange årligt)
- Bivirkningsmanagerforum (to gange årligt)
- Dialogmøder med Lægemiddelindustriforeningen og Industriforeningen for Generiske og Biosimilære Lægemidler (efter behov, men typisk årligt)
- Samarbejdsaftale med Giftlinjen, Sundhedsstyrelsen og Styrelsen for Patientsikkerhed
Derudover har Lægemiddelstyrelsen etablerede samarbejdsmøder omkring lægemiddelsikkerhed og lægemiddelovervågning med en lang række styrelser og offentlige instanser, som fx Styrelsen for Patientsikkerhed, Sundhedsstyrelsen, Statens Serum Institut og Sundhedsdatastyrelsen.
Fokus på nemmere indberetning af bivirkninger
I 2014 stillede Lægemiddelstyrelsen en ny webservice til rådighed for praktiserende læger og regionerne. Webservicen kan gøre det nemmere for sundhedspersoner at indberette bivirkninger ved medicin, hvis den integreres i lægepraksis- og hospitalssystemerne.
Siden webservicen blev stillet til rådighed har tre ud af i alt otte lægepraksissystemer (WinPLC, Ganglion og EG Clinea) implementeret webservicen.
Lægemiddelstyrelsen arbejder løbende på at udbrede og styrke kendskabet til webservicen.
Mange læger og andre sundhedspersoner oplever det som tidskrævende og besværligt at indberette bivirkninger via skemaet på Lægemiddelstyrelsens hjemmeside, fordi det kræver manuel indtastning af en lang række oplysninger fra patientens journal. Webservicen giver mulighed for at it-understøtte indberetninger af bivirkninger direkte i de lokale praksissystemer, uden at sundhedspersoner behøver, at forlade deres eget system for at indberette, og derved er det nemmere og hurtigere at indberette bivirkninger.
Ud over at webservicen giver sundhedspersoner mulighed for at indberette direkte fra for eksempel en elektronisk patientjournal på hospitalet eller i en lægepraksis, undgår man også at indtaste en række basisoplysninger manuelt som fx oplysninger om indberetter. Med webservicen bliver dele af indberetningen automatiseret og udvalgte data fra fx en patientjournal overføres direkte til indberetningen.
En bivirkningsindberetning skal mindst indeholde følgende oplysninger:
- identifikation af det mistænkte lægemiddel eller aktive stof
- en beskrivelse af den formodede bivirkning
- en eller flere oplysninger om den berørte patient: fødselsdato, CPR-nummer, køn, alder eller initialer, og
- identifikation af indberetteren, jf. § 7, stk. 1, i bekendtgørelse nr. 1823 af 15. december 2015 om indberetning af bivirkninger ved lægemidler m.m. En indberetning fra en læge, tandlæge eller jordemoder skal så vidt muligt indeholde oplysning om patientens CPR-nummer, jf. bekendtgørelsens § 7, stk. 3.
Derudover skal en indberetning fra en læge, tandlæge eller jordemoder så vidt muligt indeholde oplysninger om lægemidlets navn og batchnummer, når indberetningen vedrører et biologisk lægemiddel på en liste, der offentliggøres på Lægemiddelstyrelsens hjemmeside, jf. bekendtgørelsens § 7, stk. 2.
Interaktive bivirkningsoversigter
Lægemiddelstyrelsen oplever at mange har glæde af vores interaktive bivirkningsoversigter. Flere og flere forskere, læger, journalister og andre interesserede har fundet ud af, at de ved hjælp af oversigterne hurtigt selv kan finde svar på mange af de spørgsmål de har om indberettede formodede bivirkninger i Danmark. Fordelen ved de interaktive oversigter er, at de giver mulighed for at sætte filtre på søgningerne fx på alder, årstal, køn, alvorlighed m.m. Derudover er det også muligt at lave filtreringer på indberetter dvs. hvor indberetningerne kommer fra (fx sundhedsfagligt personale, patienter eller pårørende).
De interaktive bivirkningsoversigter giver en mulighed for trække data på, hvilke formodede bivirkninger der er indberettet i Danmark for en bestemt type medicin (det aktive lægemiddelstof). Oplysningerne kommer fra Lægemiddelstyrelsens bivirkningsdatabase, som indeholder alle indberettede formodede bivirkninger fra 1968 og frem. Databasen indeholder både indberetninger fra sundhedsfagligt personale, patienter og pårørende.
De interaktive oversigter er tilgængelige på lægemiddelstyrelsens hjemmeside og på www.bivstat.dk, og vi kan kun opfordre til at anvende dem. Det er dog væsentligt at bemærke, at bivirkningsoversigterne ikke kan give et fuldstændigt overblik over risici, der kan være forbundet med brug af medicin. Der kan derfor ikke drages konklusioner om sikkerhed og risici ved medicin udelukkende fra oplysningerne i bivirkningsoversigterne.