Kliniske forsøg med lægemidler
Vidste du at Danmark er førende i EU mht. flest kliniske forsøg pr. mio. indbygger?
14 dages sagsbehandling for fase I forsøg
Find information om hurtig sagsbehandling samlet HER.
Processen vil til en start gælde per automatik for alle mononationale fase I og fase I-II forsøg. Samtidig vil vi forsøge at imødekomme hurtig sagsbehandling af multinationale forsøg efter nærmere aftale og koordinering.
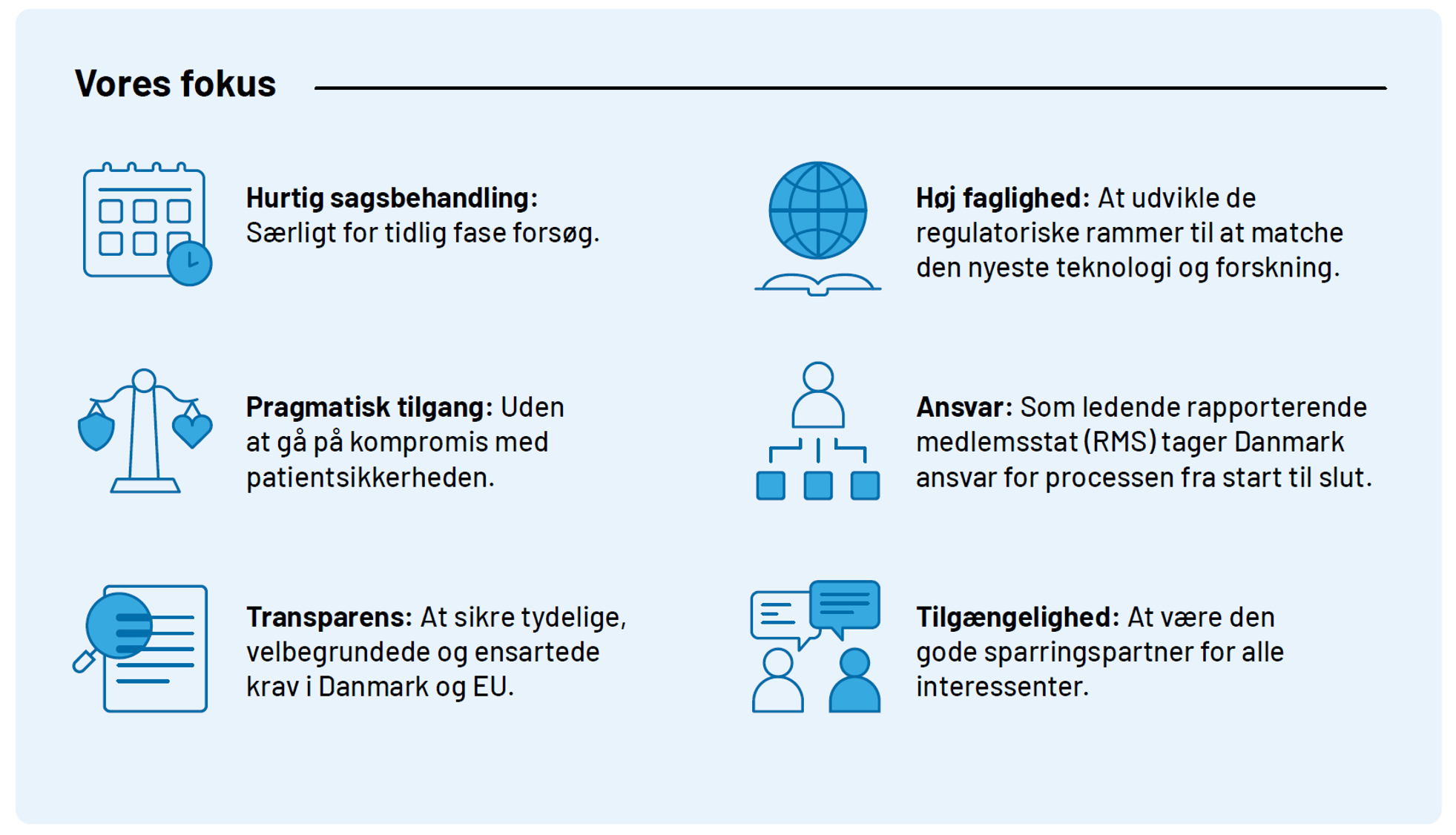
Særlige indsatsområder i 2025
- Sagsbehandlingstider for kliniske forsøg
For mononationale forsøg i Danmark prioriterer vi hurtig sagsbehandling. Målet er at mononationale forsøg modtager et svar inden for 31 dage. Dertil arbejdes der på at sikre endnu hurtigere sagsbehandling for tidlig fase forsøg.
- Kombinerede forsøg med både lægemidler og medicinsk udstyr
Vi har udviklet en national forsøgsordning, hvor der kan ansøges om, og fælles behandle, kombinerede forsøg med lægemidler og medicinsk udstyr. Erfaringer fra dette arbejder benytter vi i arbejdet med EU-projektet COMBINE, for at finde fælles løsninger for snitfladen i EU.
- Brugen af data, herunder registerdata, og avancerede dataanalyser i kliniske forsøg
Vi styrker i 2025 vores fokus på konceptet om personlig medicin ved en opkvalificering og regulatorisk rammesætning af brugen af data og avancerede dataanalyser, herunder brugen af blandt andet AI/LML, i kliniske forsøg med lægemidler.
- Kliniske forsøg med innovative lægemidler herunder avancerede terapier (ATMP)
Vi har ATMP som et prioriteret område i Kliniske Forsøg og Lægemiddelstyrelsen. Vi har samlet information specifikt relateret til regulatorisk vejledning vedrørende ATMP vores hjemmeside
Værdien af kliniske forsøg
Gennemførelsen af veldesignede og sikre kliniske forsøg er afgørende for at opbygge viden om lægemidler og udgør en central del af grundlaget for godkendelse af nye, effektive og sikre lægemidler. Dertil spiller kliniske forsøg en vital rolle i skabelsen af et attraktivt og kompetent miljø for lægemiddeludvikling og forskning i Danmark.
Kliniske forsøg giver tidlig indsigt i nye lægemiddelbehandlinger i sundhedssystemet, som opbygger kompetence - og vigtigst af alt kommer patienterne til gode, da de får hurtig adgang til de nyeste lægemidler.
Vi har i Lægemiddelstyrelsen blik for hele processen omkring lægemiddeludvikling, og mener at Danmark har forudsætninger for særligt at udmærke sig i udviklingen af nye kliniske forsøgsdesigns, forsøg med komplekse lægemidler der knytter sig til sjældne sygdomme eller individuel medicinering - samt forskning i tidlige faser, herunder ’First in Human’ (FIH) forsøg. Dette skyldes blandt andet Danmarks dygtige og specialiserede forskere samt Danmarks mange teknologiske muligheder.
Du kan læse mere om hvad et klinisk forsøg er på vores side: Hvad er et klinisk forsøg.
Generelle fokusområder
Vores sektion for Kliniske Forsøg arbejder målrettet på at forbedre rammerne for kliniske forsøg i Danmark og EU i samarbejde med interessenter fra hele økosystemet, altid med fokus på patienternes bedste. Vi har tæt samarbejde med Nationalt Center for Etik, herunder de Videnskabsetiske Medicinske Komiteer (VMK).
Vores fokus er fortsat at være i front som ledende rapporterende medlemsstat (RMS) på multinationale forsøg, levere rettidig sagsbehandling af høj kvalitet, samtidig med at vi udvikler vejledninger, der understøtter udførslen af fremtidens kliniske forsøg. Vores arbejde udføres i løbende dialog med vores omverden og med en pragmatisk tilgang, der først og fremmest har forsøgsdeltagernes sikkerhed og interesser i fokus.
Mere information om ansøgning af kliniske forsøg finder du her.
VMKs rolle kan du læse om på deres hjemmeside.
Se her figuren Vores fokus i større opløsning.
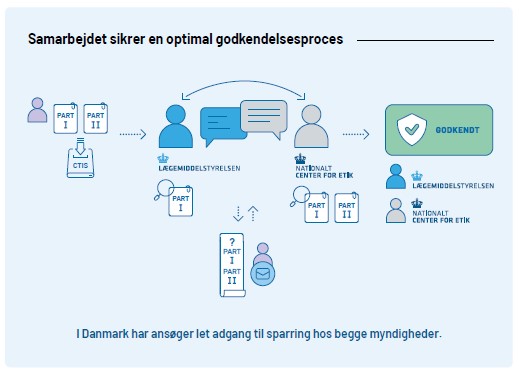
Samarbejdet om godkendelse af kliniske forsøg
Kliniske forsøg godkendes af både Lægemiddelstyrelsen og de Videnskabsetiske Medicinske Komiteer (VMK) og en samlet fælles ansøgning med Part I og Part II indsendes via den fælleseuropæiske dataportal; Clinical Trial Information System (CTIS) til begge myndigheder.
Vi optimerer godkendelsesproceduren løbende og i Danmark får du standardiseret vurdering på højt fagligt niveau, hver gang, uanset typen af forsøgsansøgning. Vi kommunikerer løbende om krav til ansøgning og om vores mål med sagsbehandlingstider for at skabe forudsigelighed om processen.
For både mononationale og multinationale forsøg udarbejder vi for Part I sammen med Videnskabsetisk Medicinsk Komite en fælles konsolideret liste af spørgsmål til sponsor. Vi bestræber os altid til at stille tydelige velbegrundede krav som er kritiske for godkendelsen, og at sponsor nemt kan se hvilke spørgsmål som kommer fra henholdsvis Lægemiddelstyrelsen og VMKomite. Ligeledes prioriterer vi hurtig vurdering af sponsors svar, så der kan stilles en anden runde af spørgsmål til sponsor ved behov: Hvis vi for Part I vurderer at forsøget har flere fordele end ulemper (positiv benefit-risk balance), forhindrer mangler af ikke-væsentligt karakter ikke forsøgsstart i Danmark.
Se her figuren over godkendelsesprocessen i større opløsning.
Vi prioriter tæt dialog med sponsor, og man kan altid komme i personlig kontakt med os. Vi vejleder om regulatoriske krav eller specifikke videnskabelige problemstillinger i kliniske forsøg, både før indsendelse af en ansøgning i CTIS, under vurdering af ansøgning og når forsøget er i gang eller er ved at blive afsluttet.
Internationalt engagement og fokus på tidlig fase forskning
Vi engagerer os nationalt og internationalt med vores interessenter for at styrke et innovativt miljø til gavn for patienter og forskning, og vægter højt fagligt niveau med udgangspunkt i seneste viden på området.
I Danmark prioriterer vi den tidlige fase forskning. Tidlig fase forsøgene giver danske patienter adgang til de nyeste behandlingsformer og opbygger en afgørende videnskapacitet hos både os som myndighed og hos danske forskere. Dette forventes at have en afsmittende gevinst i de senere faser af lægemiddeludviklingen.
Vi arbejder løbende med initiativer til at understøtte den tidlige forskning. Vi har stærke kompetencer til at støtte overgangen fra de toksikologiske studier til de kliniske forsøg og tilbyder videnskabelig rådgivning om både toksikologiske, kliniske og regulatoriske spørgsmål.
Danske erfaringer gør en forskel i Europa
Harmonisering er en væsentlig prioritet for os og vi lægger mange ressourcer i at ensrette både håndtering og vurdering af kliniske forsøgsansøgninger i EU.
Vi arbejder tæt sammen med vores europæiske kolleger om dette og bidrager aktivt i arbejdsgrupper under blandt andre EU-kommissionen, det europæiske lægemiddelagentur (EMA) og Heads of Medicines Agencies (HMA). I denne forbindelse har Lægemiddelstyrelsen blandt andet været ansvarlige for udviklingen af EU-vejledninger om komplekse kliniske forsøg, GLP krav til non-kliniske studier og decentrale kliniske forsøg.