Standardisering af kvaliteten af lægemidler i Europa
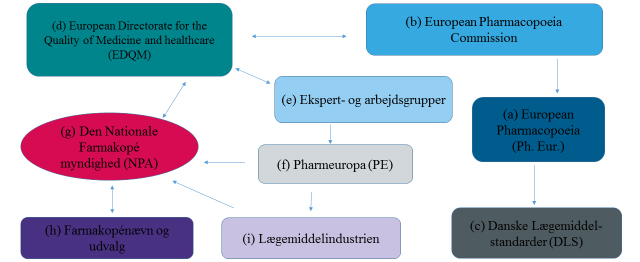
Omdrejningsnøglen i standardiseringen af kvaliteten af lægemidler i Europa er samarbejdet omkring vedligeholdelse og videreudvikling af den Europæiske Farmakopé (Ph. Eur.) (a). Mens det europæiske samarbejde omkring godkendelse af lægemidler hører under EU, så hører samarbejdet omkring lægemiddelkvaliteten under Europarådet.
Den Europæiske Farmakopé kommission (b) (Ph. Eur. kommissionen) er det øverste beslutningsorgan, der bestemmer hvilke tekster og monografier, der skal implementeres eller fjernes i Ph. Eur. Ph. Eur. kommissionen, der er repræsenteret ved 38 medlemslande plus EU som institution, og består af nationale delegationer med op til tre personer fra hvert af medlemslandene, holder møde tre gange om året. For at gøre Ph. Eur. lovmæssigt gældende i Danmark, bliver den implementeret i den danske lovgivning via Danske Lægemiddelstandarder (DLS) (c).
EDQM (d) er en administrativ afdeling/et direktorat, der varetager mange forskellige funktioner i relation til samarbejdet omkring Ph. Eur. Én af funktionerne er at varetage sekretæropgaver for dels Ph. Eur. kommissionen, men også for de forskellige ekspert- og arbejdsgrupper (e), der er tilknyttet arbejdet med Ph. Eur. En anden vigtig funktion for EDQM er at fremstille de reference standarder, som er knyttet til analysemetoderne i de specifikke Ph. Eur. monografier. Arbejdet med at udvikle nye og revidere eksisterende monografier og tekster til Ph. Eur. varetages af de forskellige ekspert- og arbejdsgrupper (e).
Når der er udarbejdet forslag til nye og reviderede tekster og monografier til Ph. Eur., sendes de i høring i Pharmeuropa (PE) (f), der publiceres fire gange om året.
Forbindelsesleddet mellem EDQM, Lægemiddelstyrelsen og de danske brugere af Ph. Eur. udgøres af Den Nationale Farmakopé myndighed (NPA) (g), som er en stabsfunktion i Lægemiddelstyrelsen. Under NPA er der oprettet et Farmakopénævn og fire faglige udvalg (h). Disse har til formål at støtte og rådgive Lægemiddelstyrelsen i beslutninger, der skal tages i relation til standardisering af kvaliteten af lægemidler. Det primære arbejde i udvalgene er at diskutere og udarbejde fælles danske kommentarer til de forslag til tekster og monografier, der kommer i høring i Pharmeuropa (PE) (f). Ud over at de faglige udvalg i samarbejde med Lægemiddelstyrelsen udarbejder kommentarer til forslag til Ph. Eur. tekster og monografier, så kan også lægemiddelindustrien (i) og andre interessenter udarbejde kommentarer. Alle de danske kommentarer bliver videreformidlet til EDQM gennem sekretæren for den Nationale Farmakopé myndighed (NPA).
Den Nationale Farmakopé myndighed kan kontaktes via postkassen Send en mail.